España, 1º Informe de Farmacovigilancia sobre vacunas COVID-19 (25-01-2021)
A la fecha de cierre de este informe (12 de enero), se habían vacunado en España 494.799 personas, habiéndose recibido 374 notificaciones de acontecimientos adversos. Los más frecuentes incluían acontecimientos relacionados con trastornos generales (fiebre, malestar), sistema nervioso central (cefalea, mareos) y aparato digestivo (náuseas, diarrea). No se ha identificado en España o en la Unión Europea ninguna posible reacción adversa hasta ahora desconocida que pueda ser motivo de preocupación. AEMPS, 25 de enero de 2021
Índice
Acontecimientos adversos notificados en España tras la vacunación (SEFV-H)
Respuestas a preguntas frecuentes sobre seguridad de las vacunas frente a COVID-19
Introducción
El presente informe incluye datos de los acontecimientos adversos ocurridos tras la vacunación con vacunas frente a la COVID-19, notificados en España hasta el 12 de enero de 2021. Adicionalmente también se han incorporado respuestas a preguntas frecuentes sobre la seguridad de este tipo de vacunas, que se irán actualizando periódicamente según sea necesario.
A fecha 12 de enero de 2021, se habían autorizado en la Unión Europea, Comirnaty (Pfizer-BioNTech), autorizada el 22 de diciembre de 2020) y COVID-19 Vaccine Moderna (autorizada el 8 de enero de 2021). En España se está vacunando siguiendo una estrategia de vacunación única en todas las CCAA, cuyo contenido se puede ver en el siguiente enlace: https://www.mscbs.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/covid19/COVID19_Vacunacion.htm. Desde el inicio de la campaña de vacunación en España el 27 de diciembre de 2020 hasta el 12 de enero de 2021, se ha administrado únicamente Comirnaty. Esta vacuna está indicada para la inmunización activa para prevenir la COVID-19 causada por el virus SARS-CoV-2, en personas de 16 años de edad y mayores. La ficha técnica y prospecto de estas vacunas se pueden consultar en el Centro de Información Online de Medicamentos de la AEMPS (CIMA).
España, junto con el resto de países de la Unión Europea, coordinados por la Agencia Europea de Medicamentos, está realizando una vigilancia estrecha para detectar y evaluar posibles nuevas reacciones adversas no identificadas durante los ensayos clínicos de las vacunas frente a la COVID-19.
Acontecimientos adversos notificados en España tras la vacunación (SEFV-H)
El Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H), integrado por los Centros Autonómicos de Farmacovigilancia y coordinado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), realiza una valoración permanente de los acontecimientos adversos notificados en España tras la vacunación. Estos acontecimientos adversos se registran en la base de datos FEDRA y el objeto de su análisis es identificar posibles nuevas reacciones adversas que deben someterse a una evaluación más amplia y profunda en la Unión Europea para tener la confirmación de que son ocasionadas por la vacuna.
Es esencial tener presente que un acontecimiento adverso es cualquier problema de salud que ocurre después de la vacunación, sin que necesariamente tenga que estar ocasionado por la vacuna, ya que puede tratarse de problemas médicos que coinciden en el tiempo o que estén relacionados con el propio acto de la vacunación.
Los datos que se presentan recogen las notificaciones recibidas en España de acontecimientos adversos ocurridos tras la vacunación frente a la COVID-19 y no se pueden considerar sospechas de reacciones adversas debidas a la vacuna.
Encontrará más información sobre qué es un acontecimiento adverso y cómo se deben de interpretar estos informes en el siguiente enlace.
Acontecimientos adversos notificados en España desde el 27 de diciembre de 2020 hasta el 12 de enero de 2021
Hasta el día 12 de enero de 2021 se vacunaron un total de 494.799 personas, el 70% mujeres. En cuanto a la distribución por grupos de edad, el 62% corresponde a personas de entre 18 y 64 años y el 38% a mayores de 65 años (fuente: Registro de Vacunación, Ministerio de Sanidad).

Figura 1: Distribución de personas vacunadas por grupo de edad y sexo
En este periodo se han registrado en FEDRA un total de 374 notificaciones de acontecimientos adversos, lo que correspondería a 79 notificaciones por cada 100.000 personas vacunadas. El 91% han sido comunicadas por profesionales sanitarios, y el 9% por ciudadanos no profesionales sanitarios.
La mayoría de los casos corresponden a mujeres (83%) y a personas de entre 18 y 64 años (67%).
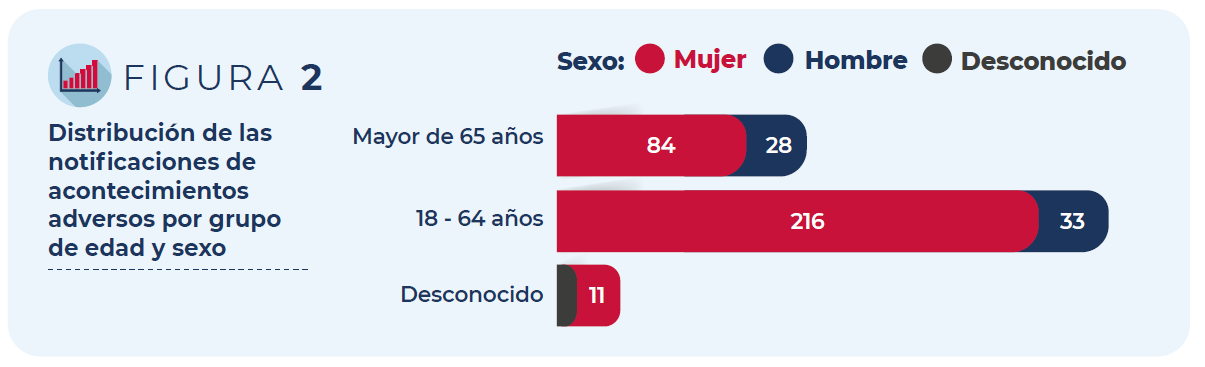
Figura 2: Distribución de las notificaciones de acontecimientos adversos por grupo de edad y sexo
Las 374 notificaciones incluyen 831 términos descriptores de acontecimientos adversos, ya que un mismo caso puede contener varios términos, por ejemplo, una persona puede haber presentado dolor en el lugar de inyección y fiebre tras la administración de la vacuna.
Los trastornos generales como fiebre o malestar general han sido los más frecuentemente notificados, seguidos de los trastornos del sistema nervioso (mayoritariamente cefaleas y mareos) y gastrointestinal (principalmente náuseas y diarrea), independientemente del grupo de edad o sexo de las personas vacunadas.
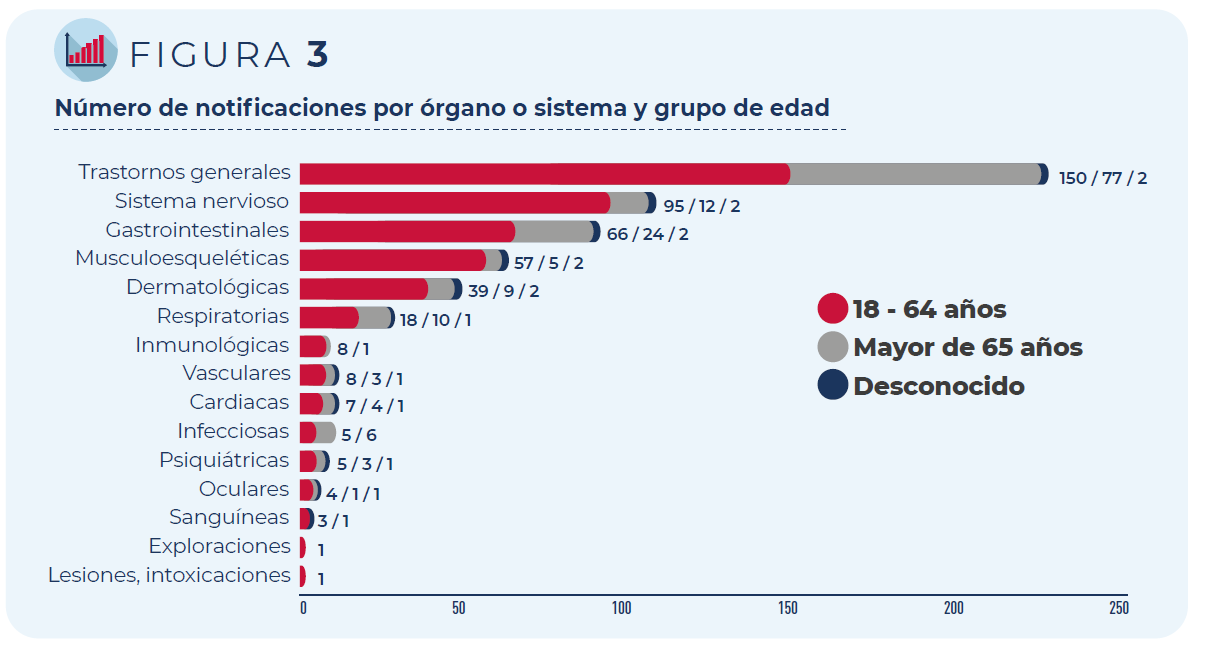
Figura 3. Distribución de las notificaciones por órgano o sistema
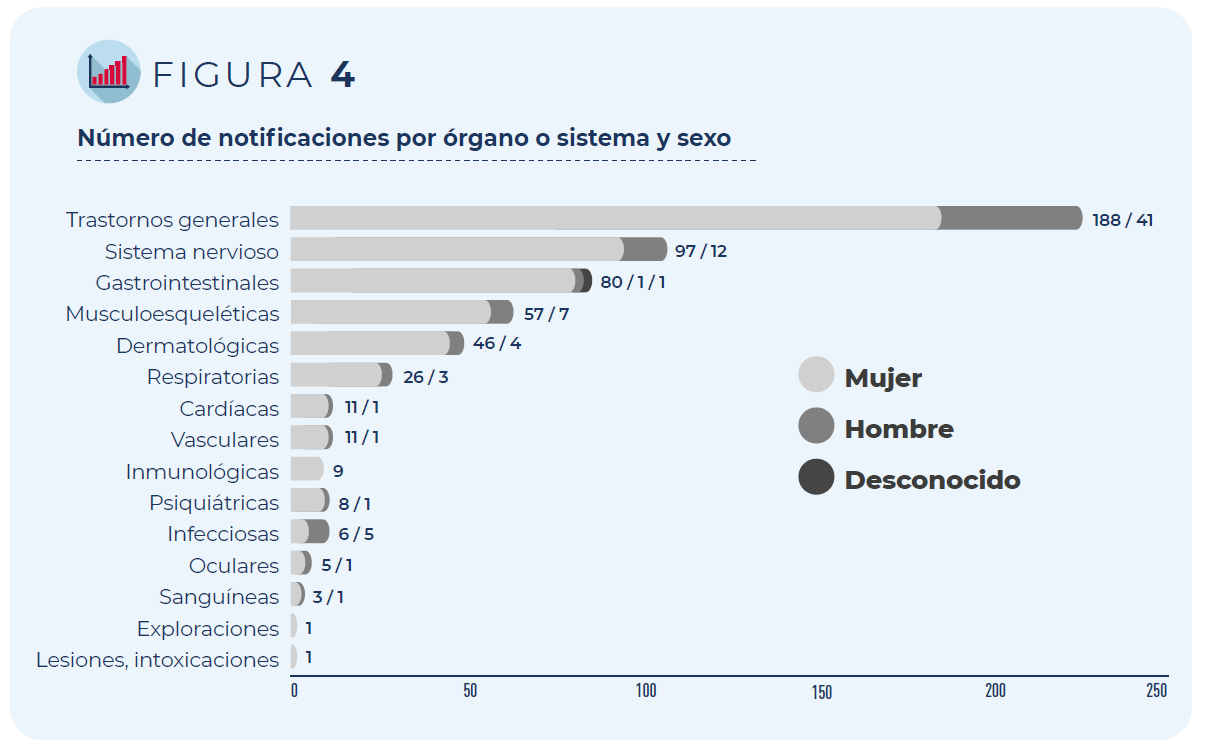
Figura 4. Número de notificaciones por órgano o sistema y sexo
Para información más detallada pueden acceder al informe dinámico a través del siguiente enlace.
La mayor atención en este periodo de tiempo ha estado centrada en los casos de anafilaxia, una reacción adversa conocida y referenciada en la ficha técnica y el prospecto de Comirnaty. Una revisión reciente del Center for Disease Control and Prevention de Estados Unidos estima una tasa de anafilaxia de 11.1 casos por millón de dosis administradas1, en base a las notificaciones recibidas que cumplen con la definición de anafilaxia establecida (Brighton Collaboration2). En España, durante el periodo analizado en este informe, se han identificado 4 casos que cumplen estos criterios de anafilaxia. Todos ellos ocurrieron en mujeres que se recuperaron o estaban en recuperación tras recibir el tratamiento correspondiente. En 3 de los casos constaban antecedentes personales de reacción alérgica.
La anafilaxia es una reacción alérgica grave muy poco frecuente que afecta simultáneamente a varios órganos, principalmente piel, sistema circulatorio y respiratorio. Los principales signos o síntomas incluyen urticaria o eritema generalizado, prurito generalizado con erupción, angioedema, hipotensión, taquicardia, disminución o pérdida de conciencia, sibilancias, estridor, inflamación de las vías respiratorias superiores o dificultad respiratoria. Generalmente aparece a los 15-30 minutos tras el contacto con el agente desencadenante y tiene una progresión rápida. Los síntomas pueden ser graves o amenazar la vida, por lo que es esencial el tratamiento inmediato con adrenalina. Es importante diferenciar una reacción alérgica de un cuadro vasovagal, ya que comparten algunos síntomas, y de otro tipo de reacciones. Encontrará recogida de forma resumida las características que pueden ayudar a diferenciarlos en el siguiente enlace.
Recuerde las recomendaciones de la ficha técnica para identificar estas reacciones y tratarlas precozmente:
- Vigilar la posible aparición de síntomas o signos sugestivos de anafilaxia en la persona vacunada durante al menos 15 minutos tras la vacunación.
- Disponer en los puntos de vacunación de la medicación necesaria para su tratamiento, incluyendo siempre adrenalina, y acceso médico inmediato en caso de que se produzca una reacción alérgica tras la administración de la vacuna.
- No vacunar a personas que tengan hipersensibilidad al principio activo o a alguno de sus excipientes.
Además, la AEMPS recomienda no administrar una segunda dosis de la vacuna a aquellos pacientes que hayan presentado una reacción alérgica clínicamente relevante (anafilaxia, angioedema, urticaria generalizada, manifestaciones respiratorias, como asma o rinitis) tras recibir la primera dosis y derivar al paciente a un servicio de alergología para estudio.
Es importante advertir a las personas vacunadas de que, en caso de aparición de algún síntoma o signo de reacción alérgica tras el periodo de observación, soliciten atención médica.
Pueden ampliar esta información en https://www.mscbs.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/covid19/COVID19_Vacunacion.htm y en las Recomendaciones FACME para la vacunación frente a COVID-19 en grupos de potencial riesgo.
- Agradecemos su colaboración notificando los acontecimientos adversos tras la vacunación frente a la COVID-19.
- Si tiene que priorizar recuerde que, al igual que con los otros medicamentos, interesan especialmente los acontecimientos adversos graves o no conocidos.
- Para más información sobre la notificación de acontecimientos adversos pulse el siguiente enlace.
Respuestas a preguntas frecuentes sobre seguridad de las vacunas frente a COVID-19
Informe original https://bit.ly/3a0cxxs
