Farmacología

Limitaciones de los desenlaces sustitutos en la aprobación acelerada de nuevos medicamentos
17 septiembre 2021
Aunque los criterios de valoración sustitutos se utilizan ampliamente para acelerar la aprobación de nuevos fármacos, la mayoría no son predictores fiables de los resultados que más importan a los pacientes. Los reguladores sólo deben aceptar criterios de valoración sustitutos cuando no sea posible generar datos sobre los resultados clínicos. British Medical Journal, 16 de septiembre de 2021.

¿Deberían las autoridades reguladoras aprobar medicamentos basados en desenlaces subrogados?
17 septiembre 2021
La controversia del aducanumab es el último ejemplo de criterios de valoración sustitutos que no predicen resultados clínicamente importantes. Sin embargo, como informan Jeanne Lenzer y Shannon Brownlee, se utilizan cada vez más como la base para las aprobaciones de medicamentos. BMJ 16 de septiembre de 2021
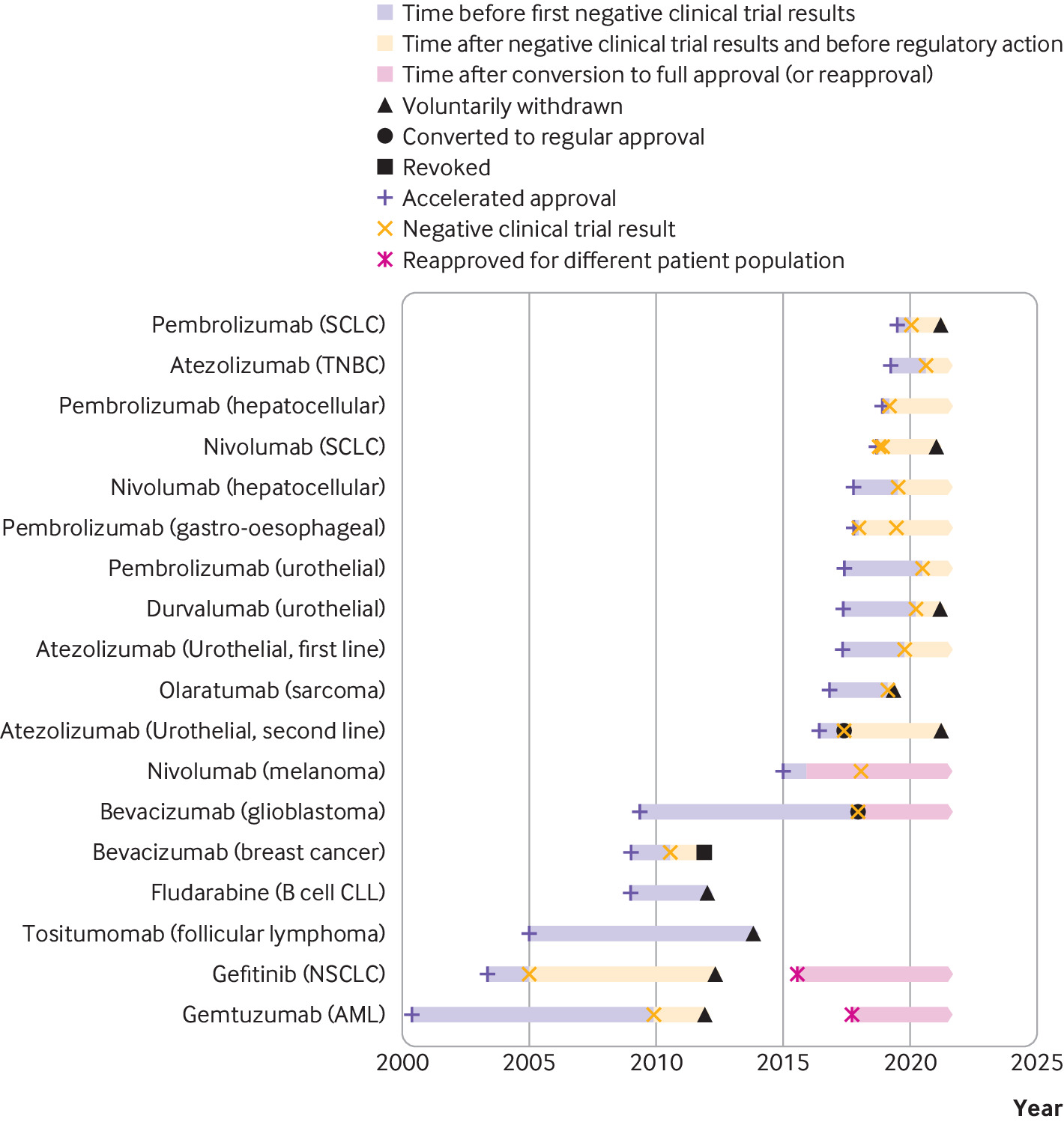
Consecuencias regulatorias y clínicas de los ensayos confirmatorios negativos de medicamentos contra el cáncer de aprobación acelerada
13 septiembre 2021
Las indicaciones de medicamentos contra el cáncer que recibieron una aprobación acelerada a menudo permanecieron en el etiquetado formal de medicamentos aprobados por la FDA y continuaron recomendándose en las guías clínicas varios años después de que los ensayos posteriores a la aprobación requeridos por ley no mostraran una mejoría en el criterio de valoración de eficacia primario. Las guías clínicas deben alinearse mejor con los resultados de los ensayos posteriores a la aprobación de medicamentos contra el cáncer que recibieron una aprobación acelerada. BMJ, 9 de septiembre de 2021

FDA permite que los medicamentos sin un beneficio clínico comprobado permanezcan durante años en la vía acelerada
30 julio 2021
"El proceso actual, que permite que los medicamentos estén en el mercado con una base de evidencia tan baja, envía señales equivocadas a otras compañías farmacéuticas, que asumirán que también pueden obtener aprobación con poca evidencia". BMJ 30 de julio de 2021

Críticas a la aprobación acelerada por la FDA de un medicamento para el Alzheimer
19 julio 2021
