Farmacología
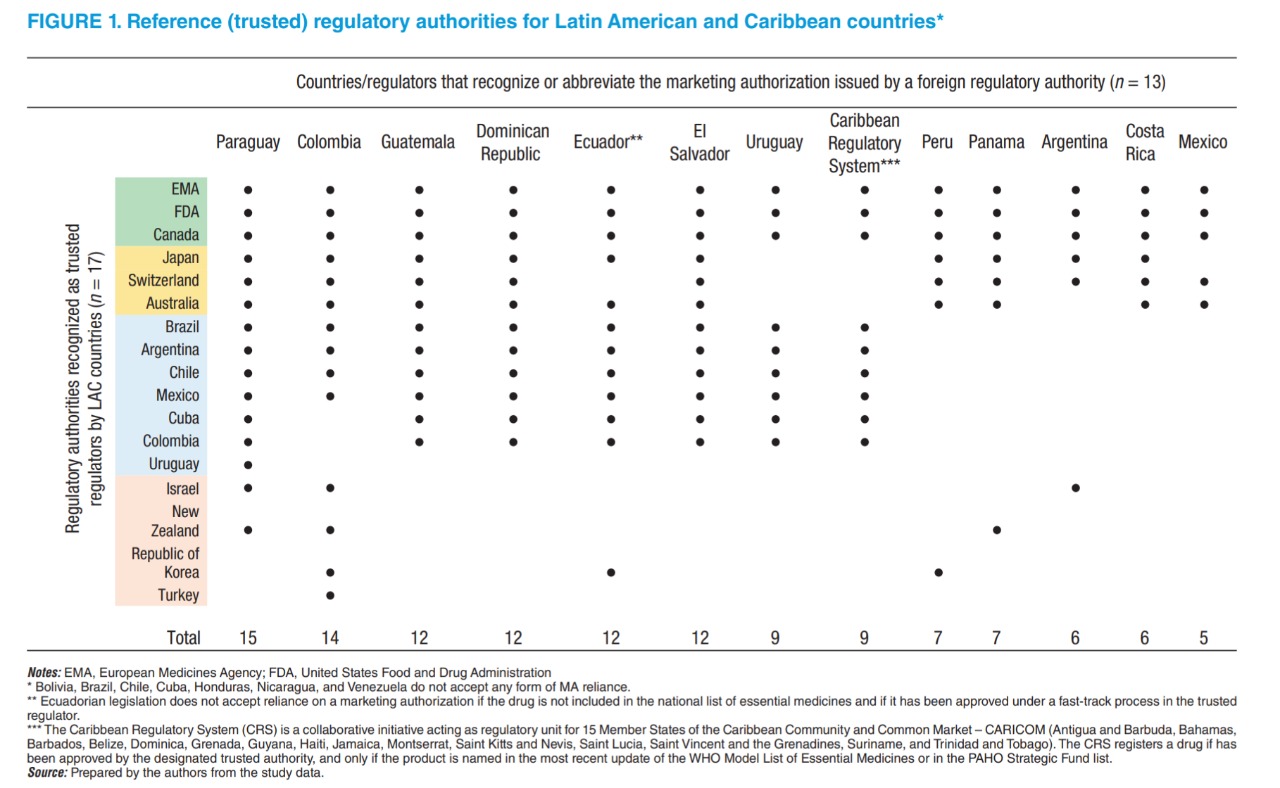
Utilización de decisiones de autoridades regulatorias de otras jurisdicciones para aprobar nuevos productos medicinales en países de América Latina y el Caribe
09 abril 2021
La utilización de las decisiones de autoridades regulatorias de otras jurisdicciones se han convertido en una práctica común en América Latina y el Caribe. Trece de veinte autoridades regulatorias reconocen directamente o abrevian el proceso de aprobación de nuevos medicamentos en caso de que hayan recibido previamente la aprobación por parte de un organismo regulatorio de otra jurisdicción. La Agencia Europea de Medicamentos, la Administración de Alimentos y Medicamentos de Estados Unidos y Salud Canadá son las autoridades regulatorias de otras jurisdicciones en las cuales los reguladores de América Latina y el Caribe confían más. Rev Panam Salud Publica, 9 de abril de 2021

Aprobación de medicamentos oncológicos por vía acelerada: discrepancias entre la FDA y las agencias europeas
23 febrero 2021
Una parte sustancial de los fármacos oncológicos aprobados por la FDA por vía acelerada no fueron evaluados por las autoridades regulatorias europeas, o se les negó o retiró la autorización de comercialización. Además, muchas de las aprobaciones en el Reino Unido quedaban sujetas a acuerdos de reducción de precios. JAMA Internal Medicine, 22 de febrero de 2021.

Propuesta de retirar del mercado un fármaco aprobado por procedimiento acelerado
10 diciembre 2020
El Centro de Evaluación e Investigación de Medicamentos de la FDA ha recomendado retirar del mercado la inyección de caproato de hidroxiprogesterona utilizada como tratamiento preventivo de la recurrencia de parto prematuro, que fuera aprobada en 2011 por vía rápida en base a desenlaces surrogados, debido a que los resultados postcomercialización no mostraron la eficacia esperada. New England Journal of Medicine, 10 de diciembre de 2020.
Asociación entre los programas de aprobación acelerada de la FDA y la EMA y el valor terapéutico de los nuevos medicamentos: estudio de cohorte retrospectivo
08 octubre 2020
Menos de un tercio de los nuevos medicamentos aprobados por la FDA y la EMA durante la última década fueron calificados como de alto valor terapéutico por al menos una de las cinco organizaciones independientes. Aunque los medicamentos acelerados tenían más probabilidades de tener una calificación alta que los medicamentos no acelerados, la mayoría de los medicamentos acelerados aprobados por la FDA, pero no por la EMA, fueron calificados como de bajo valor terapéutico. BMJ 7 de octubre de 2020

Los riesgos de las autorizaciones aceleradas para tratamientos en COVID-19.
14 septiembre 2020
