Farmacología
Asociación del mandato de la FDA que limita el paracetamol (acetaminofén) en productos combinados con opioides y hospitalizaciones e insuficiencia hepática aguda subsecuentes
13 marzo 2023
El mandato de la FDA de limitar el paracetamol a 325 mg/tableta en la combinación de paracetamol y medicamentos opioides recetados se asoció con una disminución en las hospitalizaciones relacionadas con la toxicidad por paracetamol y opioides y una disminución en la proporción de hospitalizaciones por insuficiencia hepática aguda debido a la toxicidad por paracetamol y opioides. JAMA. 7 de marzo de 2023

Modernización de la vía de aprobación acelerada de la FDA de EE. UU.
02 marzo 2023
Dado que la Aprobación Acelerada se usa predominantemente en oncología, con medicamentos contra el cáncer que representan el 85% del uso durante la última década, las reformas son muy relevantes para el desarrollo y la aprobación de nuevos medicamentos contra el cáncer. Por lo tanto, destacaremos las reformas clave y las posibles oportunidades y desafíos que podrían presentar. Lancet Oncol, 1 de marzo de 2023
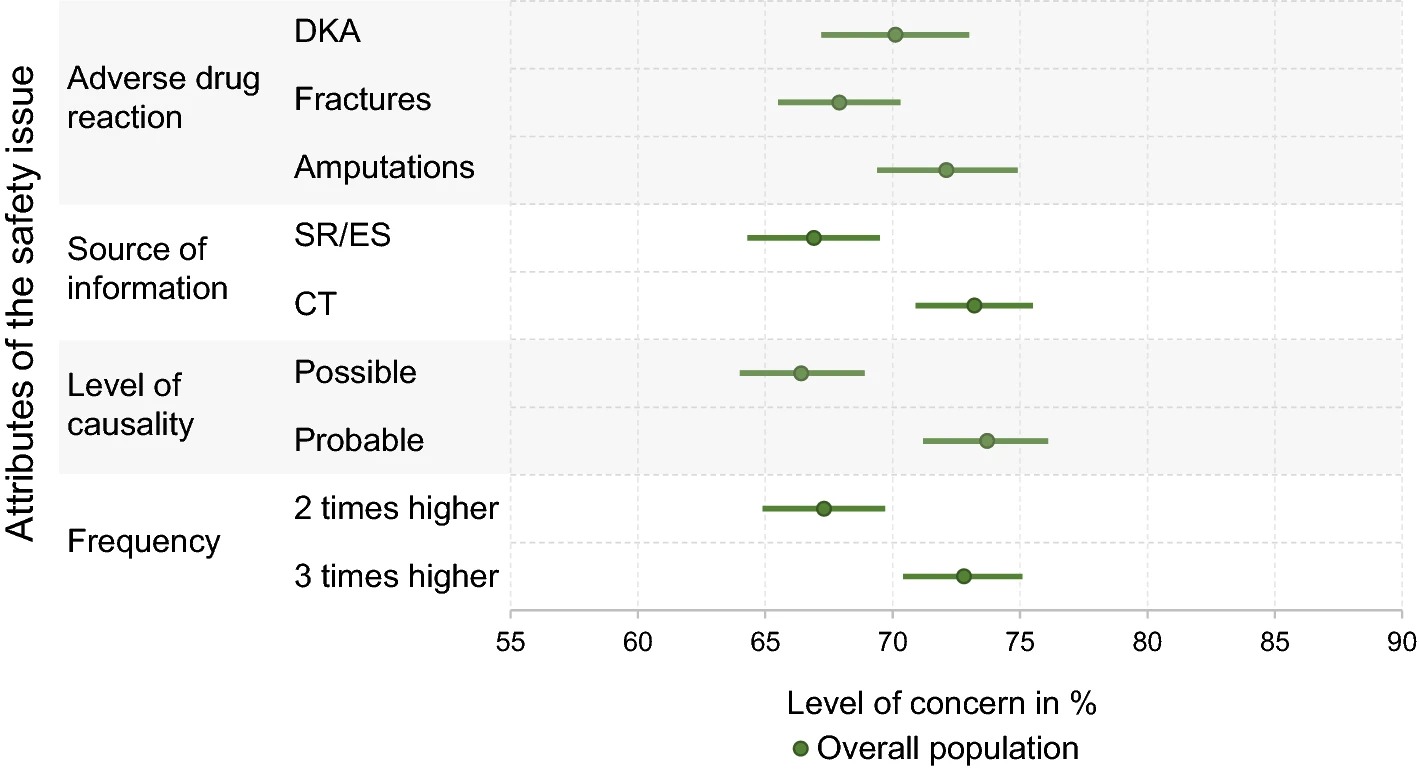
La base de evidencia de las aprobaciones de nuevas terapias contra el cáncer por la FDA, de 2000 a 2020
17 febrero 2023
Durante 21 años, los nuevos medicamentos contra el cáncer generalmente se han aprobado en función de un solo ensayo clínico, a menudo no controlado, que mide criterios de valoración alternativos. Esto deja a los pacientes con cáncer sin pruebas sólidas de que los nuevos fármacos mejoren su supervivencia o calidad de vida y no hay indicios de mejora. Int J Cáncer. 13 de febrero de 2023

Evaluación de medicamentos aprobados por la FDA no recomendados en otros países para su uso o reembolso , 2017-2020
14 febrero 2023
Este estudio transversal evaluó las razones por las cuales se denegó la autorización de comercialización de medicamentos recientemente aprobados por la FDA o no se recomendaron para reembolso público en otros países. Los medicamentos con presencia limitada en el mercado internacional pueden requerir un examen minucioso por parte de los profesionales de la salud y los sistemas de salud de los EE. UU. JAMA Intern Med. 13 de febrero de 2023

Aprobación acelerada: relación entre el momento de inicio de las pruebas confirmatorias y la aprobación final
31 enero 2023
