Farmacología
Gestión posconsumo de medicamentos en Argentina: escenario local frente al contexto internacional
21 diciembre 2023
Los resultados obtenidos en este trabajo permiten detectar 55 acciones concretas, promovidas por diversos entes, que van desde la concientización poblacional hasta la implementación de herramientas puntuales de gestión posconsumo. En virtud de los resultados obtenidos a partir de iniciativas emprendidas por organizaciones civiles y profesionales, se denota que para resolver esta problemática se requiere el compromiso político por parte de autoridades gubernamentales para instaurar políticas nacionales que, al ser acatadas, produzcan beneficios que perduren en el tiempo. Rev. Salud ambient. 15 de diciembre de 2023.
Lista de medicamentos críticos de la Unión para ayudar a evitar una posible escasez en la Unión Europea
14 diciembre 2023
La Comisión Europea (CE), los jefes de las Agencias de Medicamentos (HMA) y la EMA han publicado la primera versión de la lista de medicamentos críticos de la Unión. Contiene más de 200 sustancias activas de medicamentos de uso humano considerados críticos para los sistemas sanitarios de toda la Unión Europea (UE) y el Espacio Económico Europeo (EEE), para los cuales la continuidad del suministro es una prioridad y se debe evitar la escasez. La red europea de regulación de medicamentos dará prioridad a los medicamentos críticos en las acciones a nivel de la UE para fortalecer su cadena de suministro. EMA, 12 de diciembre de 2023
Cerrando la brecha: una investigación comparativa de las regulaciones de excipientes farmacéuticos
14 diciembre 2023
Esta revisión destaca principalmente las diferentes disposiciones que rigen la utilización de excipientes en la formulación de medicamentos por parte de las autoridades reguladoras de todo el mundo. Ther Innov Regul Sci, 6 de diciembre de 2023
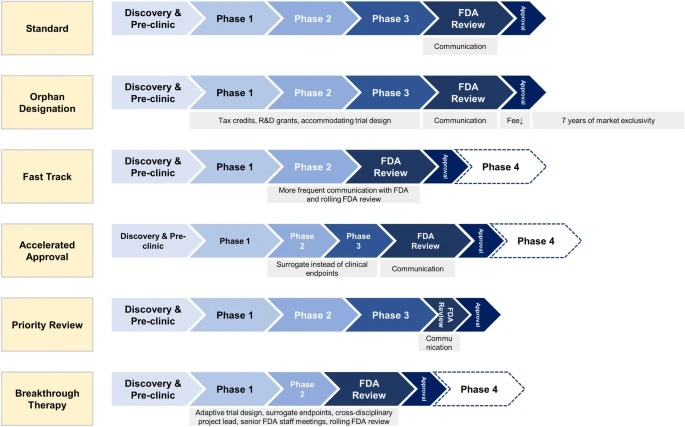
Designaciones especiales de la FDA para el desarrollo de medicamentos: huérfano, vía rápida, aprobación acelerada, revisión prioritaria y terapia innovadora
13 diciembre 2023
Las designaciones especiales de la FDA acortan los tiempos de desarrollo clínico y aprobación de la FDA para nuevos medicamentos que tratan enfermedades raras y graves con necesidades médicas no cubiertas. Los medicamentos especialmente designados ofrecen un mayor beneficio clínico a los pacientes. Sin embargo, los médicos, los pacientes y las aseguradoras deben ser conscientes de que los medicamentos designados especialmente a menudo se aprueban basándose en ensayos no sólidos, se asocian con más efectos secundarios no reconocidos y se venden a precios más altos. Eur J Health Econ, 14 noviembre 2023

Guía de Medicamentos Esenciales del Programa Nacional Remediar 2023
12 diciembre 2023
