Farmacología
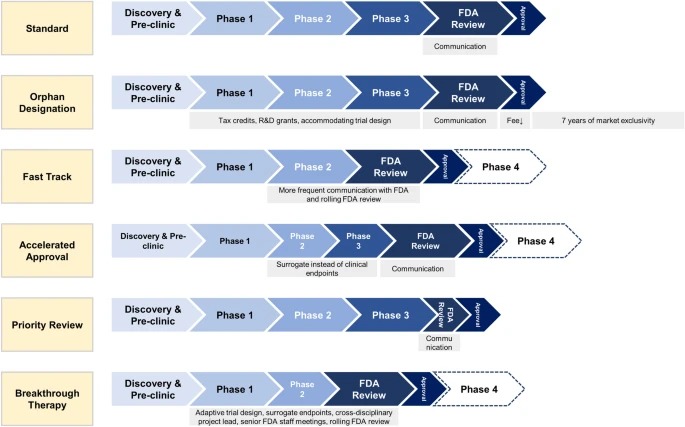
Designaciones especiales de la FDA para el desarrollo de medicamentos: huérfano, vía rápida, aprobación acelerada, revisión prioritaria y terapia innovadora
13 diciembre 2023
Las designaciones especiales de la FDA acortan los tiempos de desarrollo clínico y aprobación de la FDA para nuevos medicamentos que tratan enfermedades raras y graves con necesidades médicas no cubiertas. Los medicamentos especialmente designados ofrecen un mayor beneficio clínico a los pacientes. Sin embargo, los médicos, los pacientes y las aseguradoras deben ser conscientes de que los medicamentos designados especialmente a menudo se aprueban basándose en ensayos no sólidos, se asocian con más efectos secundarios no reconocidos y se venden a precios más altos. Eur J Health Econ, 14 noviembre 2023

¿Puede el programa Medicare no cubrir tratamientos aprobados por la FDA?
12 septiembre 2023
Frente a la aprobación de fármacos por vía acelerada, en base a resultados sobre variables subrogadas y sin demostración de eficacia en desenlaces clínicamente relevantes, el autor defiende la necesidad de limitar la cobertura social a los medicamentos de valor probado. "La capacidad de Medicare para rechazar, limitar o condicionar la cobertura de productos médicos que carecen de pruebas sólidas es crucial para salvaguardar el dinero de los contribuyentes y proteger la salud pública." El argumento se plantea para los Estados Unidos, pero se aplica por igual en todos los países. JAMA, 8 de septiembre de 2023.

Debilidad de las evidencias para la aprobación acelerada de nuevos fármacos oncológicos en China
30 agosto 2023
La mayoría de los nuevos medicamentos contra el cáncer que recibieron aprobación acelerada se basaron en tasas de respuesta en estudios sin grupo de control. Las correlaciones informadas entre los criterios de valoración subrogados y la superviviencia general (SG) fueron limitadas. Nuestros hallazgos resaltan que es esencial realizar ensayos clínicos aleatorizados y medir SG o calidad de vida para garantizar los beneficios clínicos para los pacientes. eClinicalMedicine, 24 de agosto de 2023.

Repercusiones regulatorias de la aprobación de medicamentos para la distrofia muscular sobre la base de evidencia limitada
23 agosto 2023
A pesar de los cambios legislativos y regulatorios recientes en la vía de aprobación acelerada de la FDA, la historia de eteplirsen y medicamentos similares apunta a la necesidad de reformas adicionales para equilibrar mejor la generación de evidencia con la seguridad del paciente y el acceso a medicamentos prometedores. Annals of Internal Medicine, 22 de agosto de 2023.

Comparación de nuevos medicamentos oncológicos que recibieron doble aprobación de las vías de aprobación acelerada de EE. UU. y autorización de comercialización condicional de la UE, 2006-2021
09 junio 2023
