Análisis final de eficacia, análisis de seguridad provisional e inmunogenicidad de una dosis única de la vacuna recombinante del nuevo coronavirus (Ad5-nCoV- Convidecia, Cansino-) en adultos de 18 años o más
Una dosis de Ad5-nCoV es eficaz y segura en adultos sanos de 18 años o más. Lancet, 23 de diciembre de 2021
Antecedentes
La vacuna Ad5-nCoV es una vacuna vectorizada de adenovirus tipo 5 (Ad5) de dosis única que expresa la proteína de pico SARS-CoV-2 que fue bien tolerada e inmunogénica en los estudios de fase 1 y 2. En este estudio, informamos los resultados sobre la eficacia final y los análisis de seguridad intermedios del ensayo de fase 3.
Métodos
Este ensayo clínico de fase 3, doble ciego, aleatorizado, internacional, controlado con placebo, basado en casos finales, incluyó a adultos mayores de 18 años en centros de estudio en Argentina, Chile, México, Pakistán y Rusia. Los participantes eran elegibles para el estudio si no tenían condiciones médicas o psiquiátricas subyacentes inestables o graves; no tenía antecedentes de infección por SARS-CoV-2 confirmada por laboratorio; no estaban embarazadas o amamantando; y no había recibido previamente una vacuna vectorizada por adenovirus, coronavirus o SARS-CoV-2. Después de obtener el consentimiento informado, se extrajeron 25 ml de sangre total de todos los participantes elegibles que fueron asignados al azar en una proporción de 1: 1 para recibir una dosis intramuscular única de 0,5 ml de placebo o una dosis de 0,5 ml de 5 × 1010 virus partícula (vp) / ml vacuna Ad5-nCoV; El personal del estudio y los participantes estaban cegados a la asignación del tratamiento. Todos los participantes fueron contactados semanalmente por correo electrónico, teléfono o mensaje de texto para autoinformar cualquier síntoma de la enfermedad COVID-19, y se realizaron pruebas de laboratorio para el SARS-CoV-2 a todos los participantes con cualquier síntoma. El objetivo principal de eficacia evaluó el Ad5-nCoV para prevenir la infección sintomática por COVID-19 confirmada por PCR que ocurre al menos 28 días después de la vacunación en todos los participantes que estaban al menos 28 días después de la vacunación el 15 de enero de 2021. El objetivo principal de seguridad evaluó la incidencia de cualquier evento adverso grave o evento adverso atendido médicamente después de la vacunación en todos los participantes que recibieron una inyección del estudio. Este ensayo está cerrado para la inscripción y está registrado en ClinicalTrials.gov (NCT04526990).
Hallazgos
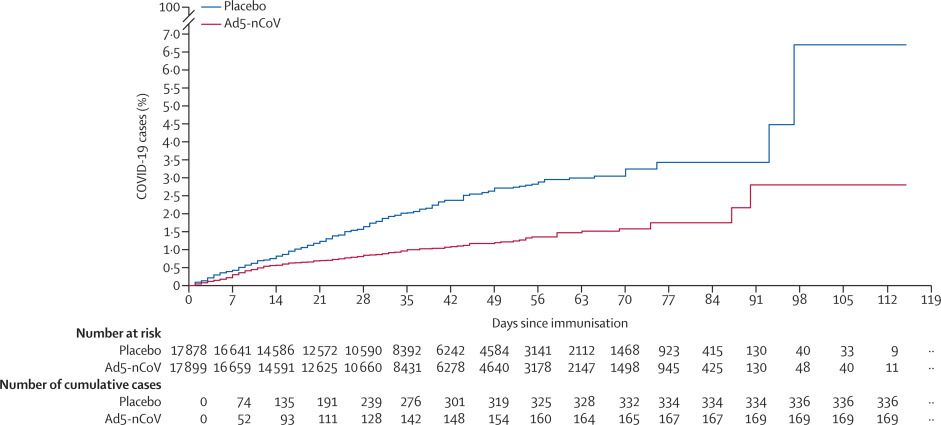
La inscripción al estudio comenzó el 22 de septiembre de 2020 en Pakistán, el 6 de noviembre de 2020, en México, el 2 de diciembre de 2020, en Rusia y Chile, y el 17 de diciembre de 2020, en Argentina; Se alcanzaron 150 casos de criterio de valoración el 15 de enero de 2021, lo que desencadenó el análisis de eficacia primario final. Una dosis de Ad5-nCoV mostró una eficacia del 57,5% (IC del 95%: 39,7-70,0, p = 0,0026) contra la infección sintomática, confirmada por PCR, por COVID-19 a los 28 días o más después de la vacunación (21 250 participantes; 45 días de duración media del seguimiento [IQR 36-58]). En el análisis de seguridad primario realizado en el momento del análisis de eficacia (36717 participantes), no hubo diferencias significativas en la incidencia de eventos adversos graves (14 [0,1%] de 18363 receptores de Ad5-nCoV y 10 [0,1%] de 18 354 receptores de placebo, p = 0,54) o eventos adversos atendidos por un médico (442 [2,4%] de 18 363 receptores de Ad5-nCoV y 411 [2,2%] de 18 354 receptores de placebo, p = 0,30) entre los grupos de Ad5-nCoV o placebo, o cualquier evento adverso grave considerado relacionado con el producto del estudio (ninguno en los receptores de Ad5-nCoV y placebo). En la cohorte de seguridad extendida, 1004 (63,5%) de 1582 de los receptores de Ad5-nCoV y 729 (46,4%) de los 1572 receptores de placebo informaron un evento adverso sistémico solicitado (p <0,0001), de los cuales el dolor de cabeza fue el más común (699 [44%] de los receptores de Ad5-nCoV y 481 [30,6%] de los receptores de placebo; p <0,0001). 971 (61,3%) de 1584 receptores de Ad5-nCoV y 314 (20 · 0%) de 1573 receptores de placebo informaron un evento adverso en el lugar de la inyección (p <0,0001), de los cuales el dolor en el lugar de la inyección fue el más frecuente; informado por 939 (59%) receptores de Ad5-nCoV y 303 (19%) receptores de placebo.
Interpretación
Una dosis de Ad5-nCoV es eficaz y segura en adultos sanos de 18 años o más.
Financiamiento
CanSino Biologics y el Instituto de Biotecnología de Beijing.
El ensayo
Scott A. Halperin, Lingyun Ye, Donna MacKinnon-Cameron, Bruce Smith, Pedro E Cahn, Guillermo M Ruiz-Palacios, et al. Final efficacy analysis, interim safety analysis, and immunogenicity of a single dose of recombinant novel coronavirus vaccine (adenovirus type 5 vector) in adults 18 years and older: an international, multicentre, randomised, double-blinded, placebo-controlled phase 3 trial. Lancet, 23 de diciembre de 2021 DOI: 10.1016/S0140-6736 (21) 02753-7