Cannabidiol transdérmico adyuvante para adultos con epilepsia focal
Ambas dosis de cannabidiol transdérmico fueron bien toleradas y seguras. No se observaron diferencias significativas en la eficacia entre el cannabidiol y el placebo durante el período de tratamiento doble ciego. La extensión del ensayo sin enmascaramiento demostró la seguridad, tolerabilidad y aceptabilidad a largo plazo de la administración transdérmica de cannabidiol. JAMA Netw Open, 8 de julio de 2022
Importancia El cannabidiol ha demostrado eficacia en ensayos clínicos aleatorizados para la epilepsia resistente a los medicamentos en síndromes específicos que afectan predominantemente a los niños. Sin embargo, falta evidencia de alto nivel sobre la eficacia y seguridad del cannabidiol en la forma más común de epilepsia resistente a los medicamentos en adultos, la epilepsia focal.
Objetivo Investigar la eficacia, seguridad y tolerabilidad del cannabidiol administrado por vía transdérmica en adultos con epilepsia focal resistente a los medicamentos.
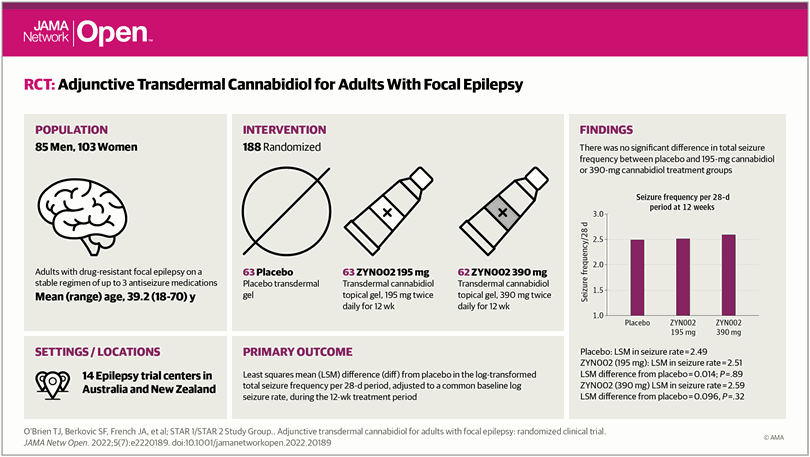
Diseño, ámbito y participantes Un ensayo clínico multicéntrico, aleatorizado, doble ciego, controlado con placebo en 14 centros de ensayos de epilepsia en Australia y Nueva Zelanda. Los participantes eran adultos con epilepsia focal resistente a los medicamentos que recibían un régimen estable de hasta 3 medicamentos anticonvulsivos. Los datos se analizaron desde julio de 2017 hasta noviembre de 2018.
Intervenciones Los participantes elegibles se asignaron al azar (1:1:1) a 195 mg o 390 mg de cannabidiol transdérmico o placebo dos veces al día durante 12 semanas, después de lo cual podían inscribirse en un estudio de extensión abierto de hasta 2 años.
Variables de desenlace y medidas principales La frecuencia de las convulsiones fue autoinformada mediante un diario. El criterio principal de valoración de la eficacia fue la diferencia media de mínimos cuadrados en la frecuencia total de convulsiones transformada logarítmicamente por período de 28 días, ajustada a una tasa de convulsiones logarítmica de referencia común, durante el período de tratamiento de 12 semanas.
Resultados Un total de 188 pacientes (45 % hombres [85 pacientes] y 54,8 % mujeres [103 pacientes]) con una edad media (DE) de 39,2 (12,78) años fueron aleatorizados, tratados y analizados (195 mg de cannabidiol, 63 participantes; cannabidiol de 390 mg, 62 participantes; placebo, 63 participantes). En la semana 12 del período doble ciego, no hubo diferencia en la frecuencia de las convulsiones entre el placebo (media [DE] 2,49 [1,31] convulsiones por 28 días) y 195 mg de cannabidiol (media [DE] 2,51 [1,15] convulsiones por 28 días). días; diferencia de medias por mínimos cuadrados, 0,014; IC del 95 %, -0,175 a 0,203; P = ,89) o 390 mg de cannabidiol (media [DE] 2,59 [DE] 2,59 [1,12] convulsiones por 28 días; diferencia de medias por mínimos cuadrados, 0,096; 95 % IC, −0,093 a 0,285; P = 0,32). Al mes 6 de la extensión de etiqueta abierta, 115 pacientes (60,8 %) lograron una reducción de las convulsiones de al menos un 50 %. Los eventos adversos emergentes del tratamiento ocurrieron en el 50,4 % (63 de 125 participantes) del grupo de cannabidiol frente al 41,3 % (26 de 63 participantes) en el grupo de placebo, con una diferencia de tratamiento del 9,1 % (IC del 95 %, -6,0 % a 23,6). %), y se produjo a tasas similares en los grupos de cannabidiol. Pocos participantes interrumpieron (7 % [14 de 188 participantes]) y la mayoría (98 % [171 de 174 participantes]) continuaron con la extensión de etiqueta abierta.
Conclusiones y relevancia Ambas dosis de cannabidiol transdérmico fueron bien toleradas y seguras. No se observaron diferencias significativas en la eficacia entre el cannabidiol y el placebo durante el período de tratamiento doble ciego. La extensión del ensayo sin enmascaramiento demostró la seguridad, tolerabilidad y aceptabilidad a largo plazo de la administración transdérmica de cannabidiol.
el ensayo
O’Brien TJ, Berkovic SF, French JA, et al. Adjunctive Transdermal Cannabidiol for Adults With Focal Epilepsy: A Randomized Clinical Trial. JAMA Netw Open. 2022;5(7):e2220189. doi:10.1001/jamanetworkopen.2022.20189