Características de diseño, riesgo de sesgo e informes de ensayos controlados aleatorios que respaldan las aprobaciones de medicamentos contra el cáncer por la Agencia Europea de Medicamentos, 2014-16
BMJ,18 de septiembre de 2019 La mayoría de los estudios pivotales que formaron la base de la aprobación EMA de nuevos medicamentos contra el cáncer entre 2014 y 2016 fueron ensayos controlados aleatorios. Sin embargo, se consideró que casi la mitad de ellos tenían un alto riesgo de sesgo en función de su diseño, conducta o análisis, algunos de los cuales podrían ser inevitables debido a la complejidad de los ensayos de cáncer. Los documentos reglamentarios y la literatura científica tenían lagunas en sus informes. Las publicaciones en revistas no reconocieron las limitaciones clave de la evidencia disponible identificada en los documentos reglamentarios.
BMJ,18 de septiembre de 2019
Objetivo Examinar las características de diseño, el riesgo de sesgo y la idoneidad de los informes de ensayos controlados aleatorios fundamentales de medicamentos contra el cáncer aprobados por la Agencia Europea de Medicamentos (EMA).
Diseño análisis transversal.
Ámbito documentos reglamentarios europeos, registros de registros de ensayos clínicos, protocolos, publicaciones en revistas y apéndices complementarios.
Criterios de elegibilidad Ensayos controlados aleatorios pivotales de nuevos medicamentos contra el cáncer aprobados por la EMA entre 2014 y 2016.
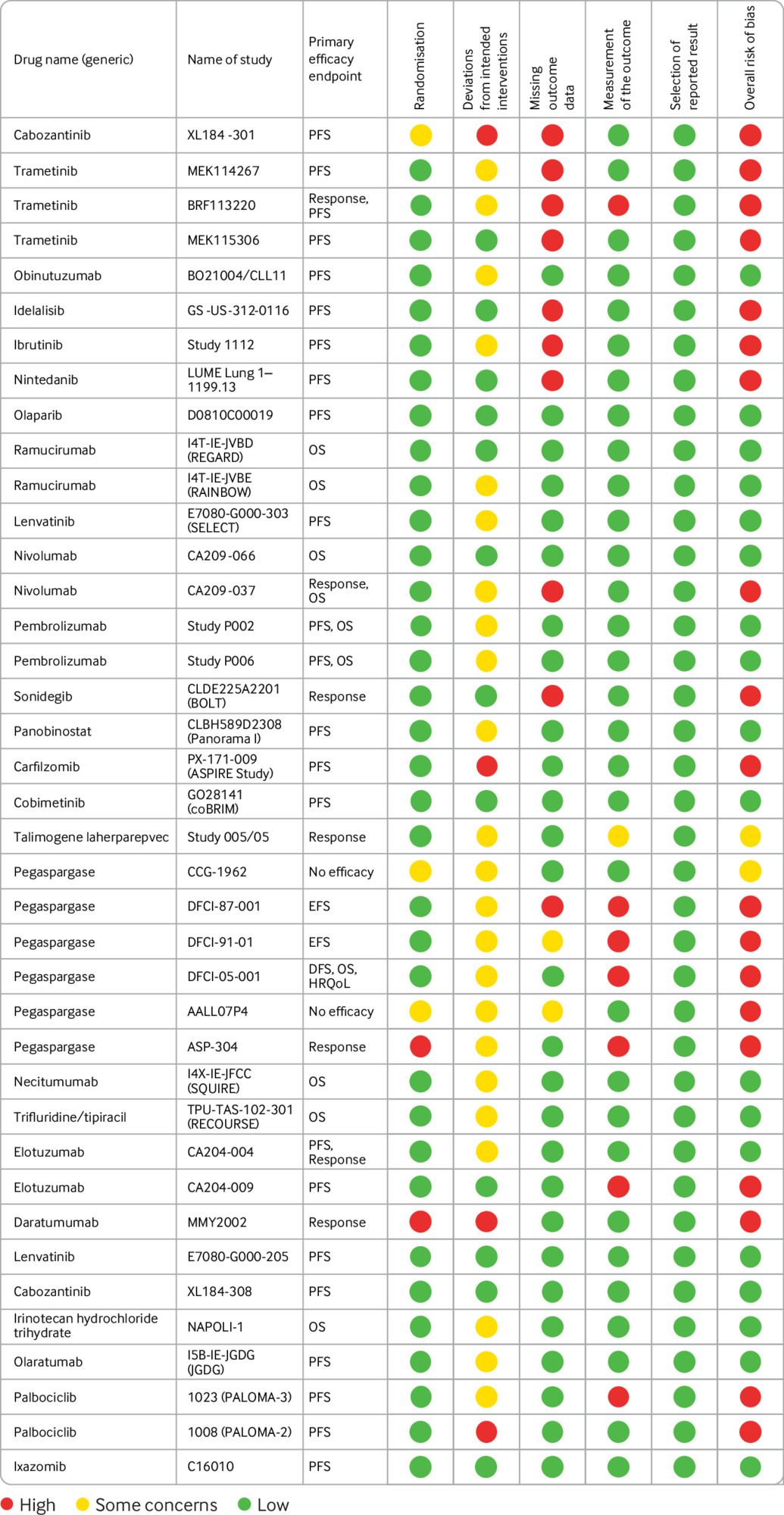
Variables desenlace Características del diseño del estudio (asignación al azar, comparadores y puntos finales); riesgo de sesgo utilizando la herramienta revisada Cochrane (sesgo derivado del proceso de asignación al azar, desviaciones de las intervenciones previstas, datos de resultados faltantes, medición del resultado y selección del resultado informado); e informes de adecuación (integridad y consistencia de la información en protocolos de ensayos, publicaciones, apéndices suplementarios, registros de registros de ensayos clínicos y documentos reglamentarios).
Resultados Entre 2014 y 2016, la EMA aprobó 32 nuevos medicamentos contra el cáncer sobre la base de 54 estudios pivotales. De estos, 41 (76%) eran ensayos controlados aleatorios y 13 (24%) eran estudios no aleatorios o estudios de brazo único. 39/41 ensayos controlados aleatorios tenían publicaciones disponibles y se incluyeron en nuestro estudio. Solo 10 ensayos controlados aleatorios (26%) midieron la supervivencia general como punto final primario o coprimario, y los ensayos restantes evaluaron medidas subrogadas como supervivencia libre de progresión y tasas de respuesta. En general, se consideró que 19 ensayos controlados aleatorios (49%) tenían un alto riesgo de sesgo para su resultado primario. Las preocupaciones sobre la falta de datos de resultado (n = 10) y la medición del resultado (n = 7) fueron los dominios más comunes que condujeron a un alto riesgo de juicio de sesgo. Menos ensayos controlados aleatorios que evaluaron la supervivencia general como criterio de valoración primario tenían un alto riesgo de sesgo que los que evaluaron los criterios de valoración sustitutivos de eficacia (2/10 (20%) v 16/29 (55%), respectivamente). Cuando la información disponible en los documentos reglamentarios y la literatura científica se consideró por separado, el juicio general de riesgo de sesgo difirió para ocho ensayos controlados aleatorios (21%), lo que refleja la insuficiencia de informes en ambas fuentes de información. Los reguladores identificaron déficits adicionales más allá de los dominios capturados en las evaluaciones de riesgo de sesgo para 10 medicamentos (31%). Estos déficits incluyeron la magnitud del beneficio clínico, los comparadores inapropiados y los puntos finales de estudio no preferidos, que no se revelaron como limitaciones en las publicaciones científicas.
Conclusiones La mayoría de los estudios pivotales que formaron la base de la aprobación EMA de nuevos medicamentos contra el cáncer entre 2014 y 2016 fueron ensayos controlados aleatorios. Sin embargo, se consideró que casi la mitad de ellos tenían un alto riesgo de sesgo en función de su diseño, conducta o análisis, algunos de los cuales podrían ser inevitables debido a la complejidad de los ensayos de cáncer. Los documentos reglamentarios y la literatura científica tenían lagunas en sus informes. Las publicaciones en revistas no reconocieron las limitaciones clave de la evidencia disponible identificada en los documentos reglamentarios.
el trabajo
Naci Huseyin, Davis Courtney, Savović Jelena, Higgins Julian P T, Sterne Jonathan A C, Gyawali Bishal et al. Design characteristics, risk of bias, and reporting of randomised controlled trials supporting approvals of cancer drugs by European Medicines Agency, 2014-16: cross sectional analysis BMJ 2019; 366 :l5221