Células T CAR y terapias con células T para el cáncer: una revisión científica traslacional
La terapia con células T CAR es una terapia aprobada por la FDA que ha mejorado la supervivencia libre de progresión para el mieloma múltiple, la supervivencia general para el linfoma de células B grandes y ha logrado altas tasas de remisión del cáncer para otras neoplasias hematológicas, como la leucemia linfoblástica aguda, el linfoma folicular y el linfoma de células del manto. Las terapias basadas en linfocitos T aprobadas recientemente demostraron el potencial para mejorar los resultados en las neoplasias malignas de tumores sólidos. Se revisan aquí el mecanismo, eficacia y efectos adversos de su uso. JAMA, noviembre de 2024.
Resumen
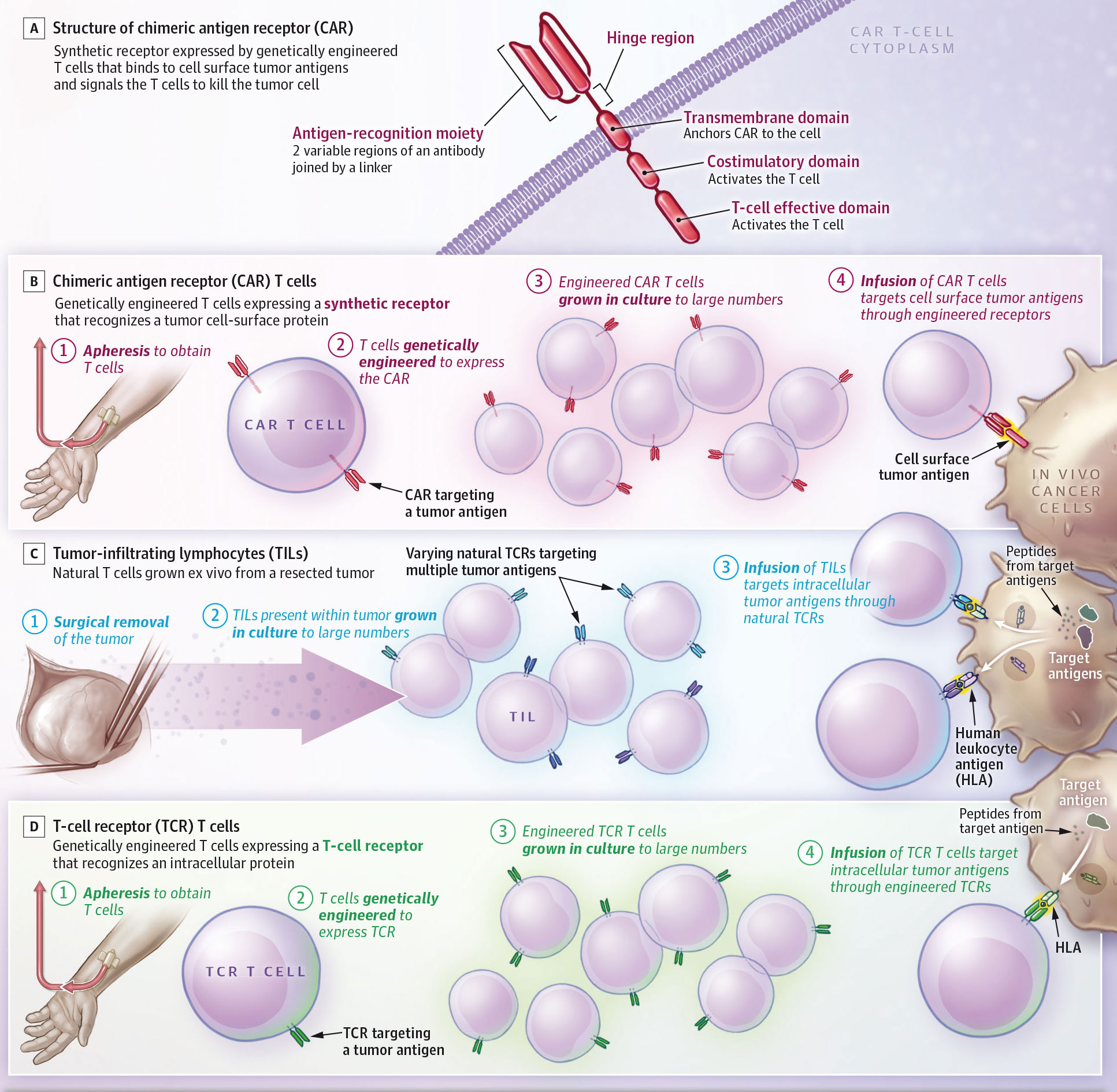
Importancia: Las células T con receptor de antígeno quimérico (CAR) son linfocitos T que se modifican genéticamente para expresar un receptor sintético que reconoce un antígeno de superficie de la célula tumoral y hace que la célula T destruya la célula tumoral. Los tratamientos con CAR T mejoran la supervivencia general de los pacientes con linfoma de células B grandes y la supervivencia sin progresión de la enfermedad de los pacientes con mieloma múltiple.
Observaciones: La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) ha aprobado seis productos de células T con CAR para seis neoplasias hematológicas: leucemia linfoblástica aguda de células B, linfoma de células B grandes, linfoma folicular, linfoma de células del manto, leucemia linfocítica crónica y mieloma múltiple. En comparación con la quimioterapia estándar seguida de un trasplante de células madre, las células T con CAR mejoraron la supervivencia general a los 4 años en pacientes con linfoma de células B grandes (54,6 % frente a 46,0 %). Los pacientes con leucemia linfoblástica aguda pediátrica alcanzaron una remisión duradera después de la terapia con células T con CAR. A los 3 años de seguimiento, el 48 % de los pacientes estaban vivos y sin recaídas. En personas con mieloma múltiple tratadas previamente con 1 a 4 tipos de terapia de células T no CAR, la terapia de células T CAR prolongó las remisiones sin tratamiento en comparación con los tratamientos estándar (en un ensayo, la terapia de células T CAR se asoció con una supervivencia sin progresión de 13,3 meses en comparación con 4,4 meses con la terapia estándar). La terapia de células T CAR se asocia con toxicidades agudas reversibles, como el síndrome de liberación de citocinas en aproximadamente el 40% al 95% de los pacientes, y trastornos neurológicos en aproximadamente el 15% al 65%. Las nuevas terapias de células T CAR en desarrollo tienen como objetivo aumentar la eficacia, disminuir los efectos adversos y tratar otros tipos de cáncer. Ninguna terapia de células T CAR está aprobada por la FDA para tumores sólidos, pero recientemente, otros 2 tratamientos basados en linfocitos T obtuvieron aprobaciones: 1 para melanoma y 1 para sarcoma de células sinoviales. Otras terapias celulares han logrado respuestas para ciertos tumores sólidos, incluidos el neuroblastoma pediátrico, el sarcoma de células sinoviales, el melanoma y los cánceres asociados al virus del papiloma humano. Un efecto adverso común que ocurre con estas terapias basadas en linfocitos T es el síndrome de extravasación capilar, que se caracteriza por retención de líquidos, edema pulmonar y disfunción renal.
Conclusiones y relevancia: La terapia con células T CAR es una terapia aprobada por la FDA que ha mejorado la supervivencia libre de progresión para el mieloma múltiple, ha mejorado la supervivencia general para el linfoma de células B grandes y ha logrado altas tasas de remisión del cáncer para otras neoplasias hematológicas, como la leucemia linfoblástica aguda, el linfoma folicular y el linfoma de células del manto. Las terapias basadas en linfocitos T aprobadas recientemente demostraron el potencial para mejorar los resultados en las neoplasias malignas de tumores sólidos.
El artículo original:
Brudno JN, Maus MV, Hinrichs CS. CAR T Cells and T-Cell Therapies for Cancer: A Translational Science Review. JAMA. Published online November 04, 2024. doi:10.1001/jama.2024.19462
El artículo original: https://n9.cl/awsgw