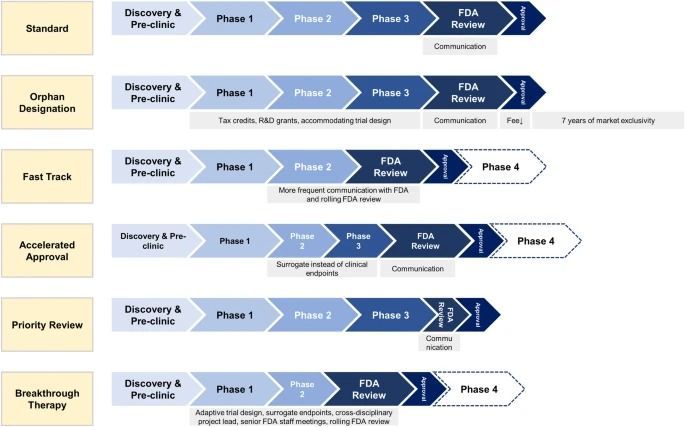
Designaciones especiales de la FDA para el desarrollo de medicamentos: huérfano, vía rápida, aprobación acelerada, revisión prioritaria y terapia innovadora
Las designaciones especiales de la FDA acortan los tiempos de desarrollo clínico y aprobación de la FDA para nuevos medicamentos que tratan enfermedades raras y graves con necesidades médicas no cubiertas. Los medicamentos especialmente designados ofrecen un mayor beneficio clínico a los pacientes. Sin embargo, los médicos, los pacientes y las aseguradoras deben ser conscientes de que los medicamentos designados especialmente a menudo se aprueban basándose en ensayos no sólidos, se asocian con más efectos secundarios no reconocidos y se venden a precios más altos. Eur J Health Econ, 14 noviembre 2023
Antecedentes
Durante las últimas décadas, el Congreso de los EE. UU. permitió a la Administración de Alimentos y Medicamentos (FDA) de los EE. UU. facilitar y acelerar el desarrollo de medicamentos para afecciones graves que satisfagan necesidades médicas no satisfechas con cinco designaciones especiales y vías de revisión: huérfano, vía rápida, aprobación acelerada, revisión prioritaria y terapia innovadora.
Objetivos
Este estudio revisa las cinco designaciones especiales de la FDA para el desarrollo de medicamentos con respecto a su seguridad, eficacia/beneficio clínico, ensayos clínicos, innovación, incentivos económicos, cronogramas de desarrollo y precio.
Métodos
Realizamos una búsqueda de palabras clave para identificar estudios que analizan el impacto de las designaciones especiales de la FDA (huérfano, vía rápida, aprobación acelerada, revisión prioritaria y terapia innovadora) sobre la seguridad, eficacia/beneficio clínico, ensayos, innovación, incentivos económicos, tiempos de desarrollo. y fijación de precios de nuevos medicamentos. Los resultados se resumieron en una descripción narrativa.
Resultados
La aprobación acelerada reduce el tiempo de comercialización de nuevos medicamentos. Sin embargo, un desarrollo de fármacos y una revisión regulatoria más rápidos se asocian con más eventos adversos no reconocidos y revisiones de seguridad posteriores a la comercialización. Los ensayos clínicos que respaldan aprobaciones especiales de la FDA utilizan con frecuencia diseños pequeños, no aleatorios y de etiqueta abierta. Los ensayos necesarios posteriores a la aprobación para monitorear eventos adversos desconocidos a menudo se retrasan o ni siquiera se inician. La evidencia sugiere que los medicamentos aprobados bajo vías de revisión especiales, comercializados como “ avances ”, son más innovadores y brindan un mayor beneficio clínico que aquellos que reciben la aprobación estándar de la FDA. Las designaciones especiales son una estrategia económicamente viable para que los inversores y las empresas farmacéuticas desarrollen medicamentos para enfermedades raras con necesidades médicas no cubiertas, debido a los incentivos financieros, los plazos de desarrollo acelerados, las mayores tasas de éxito de los ensayos clínicos y los precios más altos. Sin embargo, a los pacientes, médicos y aseguradores les preocupa gastar dinero en medicamentos sin un beneficio demostrado o incluso en medicamentos que resultan ineficaces. Si bien los países europeos establecieron acuerdos de entrada gestionada basados en el desempeño y en la financiación para tener en cuenta esta incertidumbre en la evidencia de los ensayos clínicos y la rentabilidad, el precio y el reembolso de estos medicamentos siguen en gran medida sin regular en los EE. UU.
Conclusión
Las designaciones especiales de la FDA acortan los tiempos de desarrollo clínico y aprobación de la FDA para nuevos medicamentos que tratan enfermedades raras y graves con necesidades médicas no cubiertas. Los medicamentos especialmente designados ofrecen un mayor beneficio clínico a los pacientes. Sin embargo, los médicos, los pacientes y las aseguradoras deben ser conscientes de que los medicamentos designados especialmente a menudo se aprueban basándose en ensayos no sólidos, se asocian con más efectos secundarios no reconocidos y se venden a precios más altos.
El trabajo original
Michaeli, D.T., Michaeli, T., Albers, S. et al. Special FDA designations for drug development: orphan, fast track, accelerated approval, priority review, and breakthrough therapy. Eur J Health Econ (2023). DOI: 10.1007/s10198-023-01639-x
Disponible en https://n9.cl/wa8j3m