Evidencia de ensayos clínicos que respalda la aprobación de nuevas terapias contra el cáncer por parte de la Administración de Alimentos y Medicamentos de EE. UU. Entre 2000 y 2016
En este estudio de eficacia comparativa de 92 nuevas terapias contra el cáncer aprobadas para 100 indicaciones durante 17 años, el 44% de las aprobaciones de medicamentos se basaron en datos de ensayos clínicos no aleatorizados. Los ensayos clínicos aleatorizados generalmente informaron que estos medicamentos se asociaron con respuestas tumorales sustanciales y retrasos en el tiempo hasta la progresión o la muerte, pero el aumento absoluto medio en la supervivencia general fue de solo 2 meses. JAMA Netw Open. 2 de noviembre de 2020
Importancia: La evidencia de ensayos clínicos que se utiliza para respaldar la aprobación de medicamentos suele ser la única información sobre los beneficios y los daños que los pacientes y los médicos pueden utilizar para la toma de decisiones cuando estén disponibles nuevas terapias contra el cáncer. Varias evaluaciones han suscitado preocupación por la incertidumbre que rodea a estos datos, y se justifica una investigación sistemática de la información disponible sobre los resultados del tratamiento de los medicamentos contra el cáncer aprobados por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA).
Objetivo: Describir los datos de ensayos clínicos disponibles sobre los resultados del tratamiento en el momento de la aprobación de la FDA de todos los nuevos medicamentos contra el cáncer aprobados por primera vez entre 2000 y 2016.
Diseño, ámbito y participantes: este estudio de efectividad comparativa analizó ensayos clínicos aleatorizados y ensayos clínicos de un solo brazo de nuevos fármacos aprobados por primera vez para tratar cualquier tipo de cáncer. Los paquetes de aprobación se obtuvieron de drugs @ FDA, una base de datos disponible públicamente que contiene información sobre medicamentos y productos biológicos aprobados para uso humano en los EE. UU. En este estudio se incluyeron datos de enero de 2000 a diciembre de 2016.
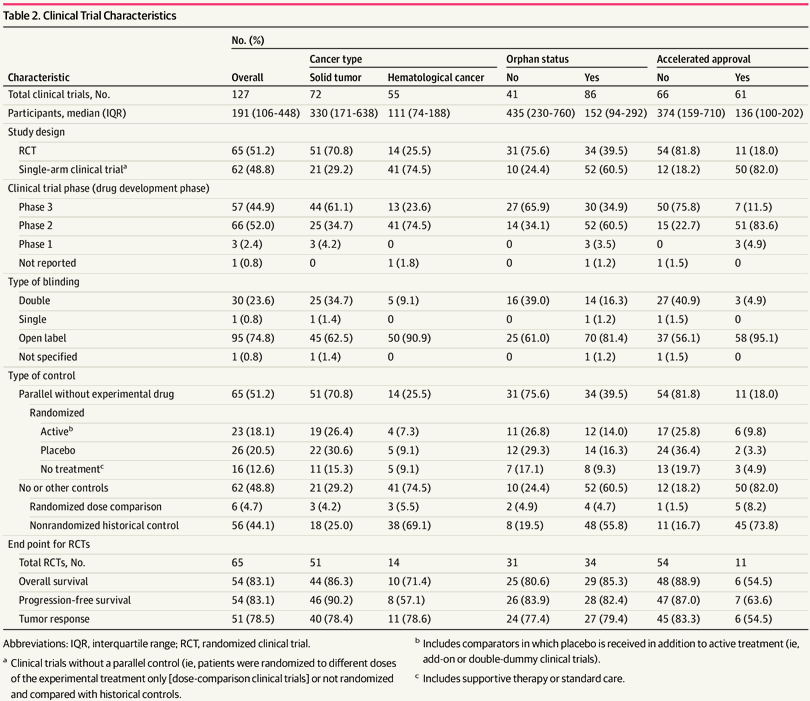
Variables de desenlace principales: Se describieron las características reglamentarias y de los ensayos clínicos. Para los ensayos clínicos aleatorizados, se calcularon los resultados del tratamiento resumidos para la supervivencia general, la supervivencia libre de progresión y la respuesta tumoral en todas las terapias, y se estimaron los aumentos de la supervivencia absoluta media. Los tipos de tumores y las características reguladoras se evaluaron por separado.
Resultados: entre 2000 y 2016, la FDA aprobó 92 nuevos medicamentos contra el cáncer para 100 indicaciones según los datos de 127 ensayos clínicos. Los 127 ensayos clínicos incluyeron una mediana de 191 participantes (rango intercuartílico [IQR], 106-448 participantes). En general, 65 ensayos clínicos (51,2%) fueron aleatorios y 95 ensayos clínicos (74,8%) fueron de etiqueta abierta. De 100 indicaciones, 44 se sometieron a aprobación acelerada, 42 indicaciones fueron para cánceres hematológicos y 58 indicaciones fueron para tumores sólidos. Los fármacos nuevos tenían una razón de riesgo media de 0,77 (IC del 95%, 0,73-0,81; I2 = 46%) para la supervivencia general y 0,52 (IC del 95%, 0,47-0,57; I2 = 88%) para la supervivencia libre de progresión. La mediana de la respuesta tumoral, expresada como riesgo relativo, fue de 2,37 (IC del 95%, 2,00-2,80; I2 = 91%). El beneficio de supervivencia absoluta mediana fue de 2,40 meses (IQR, 1,25-3,89 meses).
Conclusiones y relevancia: En este estudio, los datos disponibles en el momento de la aprobación del fármaco por la FDA indicaron que las nuevas terapias contra el cáncer se asociaron con respuestas tumorales sustanciales, pero con una prolongación de la mediana de supervivencia general en solo 2,4 meses. Los datos de aprobación de 17 años de ensayos clínicos sugirieron que los pacientes y los médicos generalmente tenían información limitada disponible sobre los beneficios de los nuevos tratamientos contra el cáncer en el momento de la entrada al mercado.
El artículo original
Ladanie A, Schmitt AM, Speich B, Naudet F, Agarwal A, Pereira TV, Sclafani F, Herbrand AK, Briel M, Martin-Liberal J, Schmid T, Ewald H, Ioannidis JPA, Bucher HC, Kasenda B, Hemkens LG. Clinical Trial Evidence Supporting US Food and Drug Administration Approval of Novel Cancer Therapies Between 2000 and 2016. JAMA Netw Open. 2020 Nov 2;3(11):e2024406. doi: 10.1001/jamanetworkopen.2020.24406.