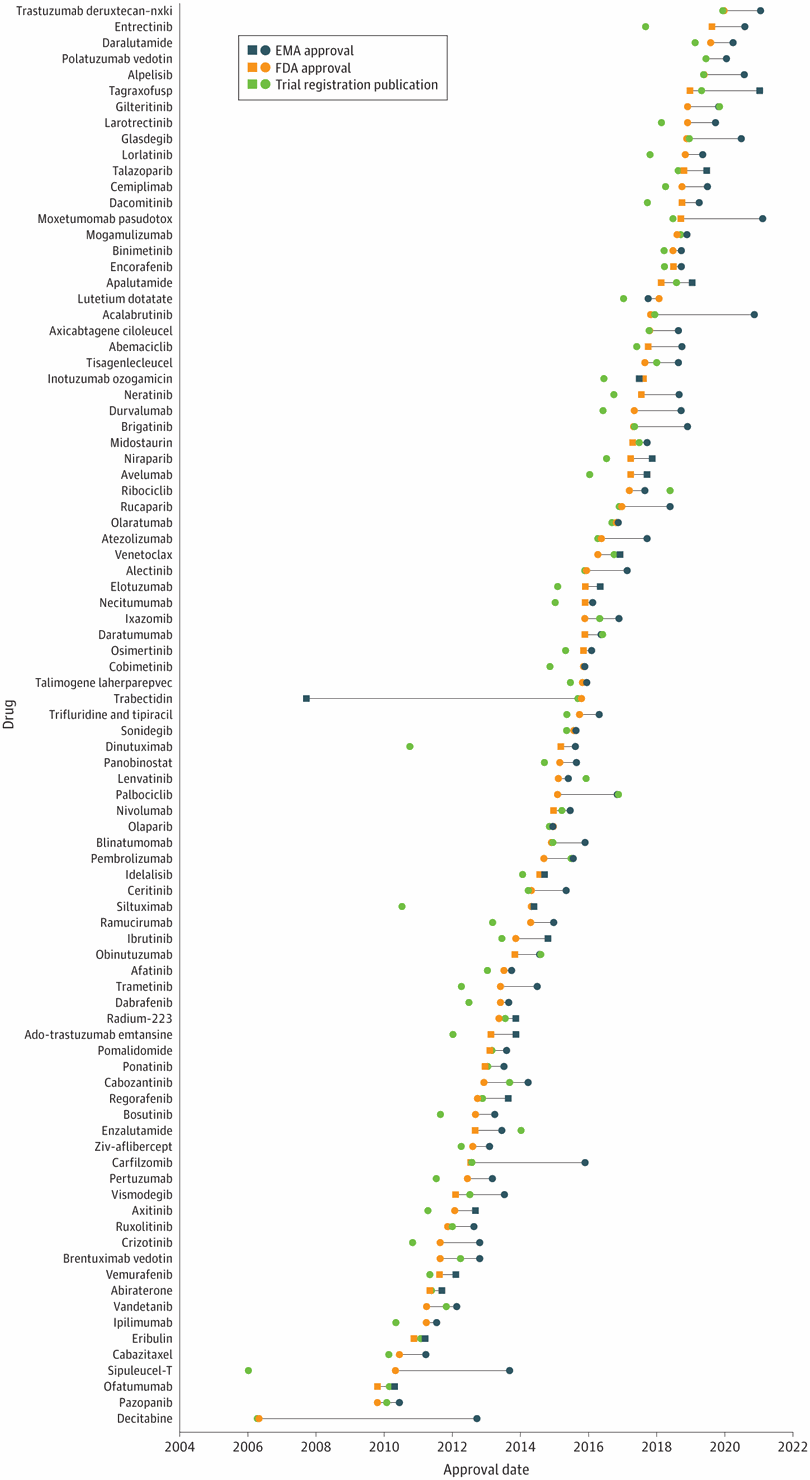
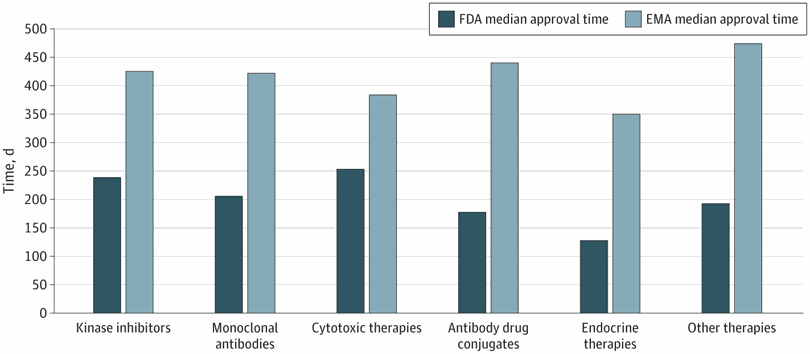
Plazos de aprobación de la terapia del cáncer, velocidad de revisión y publicación de ensayos de registro pivotales en los EE. UU. y Europa, 2010-2019
En este estudio transversal, las nuevas terapias oncológicas se aprobaron antes en EE. UU. que en Europa. La FDA recibió las solicitudes de licencia antes y tuvo tiempos de revisión más cortos. Sin embargo, se aprobaron más terapias antes de la publicación del estudio pivotal, lo que genera incertidumbre para los profesionales con respecto a la utilidad clínica y la seguridad de las terapias recientemente aprobadas. JAMA Netw Open. 10 de junio de 2022
Importancia Garantizar que los pacientes tengan acceso a medicamentos seguros y eficaces de manera oportuna es un objetivo esencial para las agencias reguladoras, que tiene una importancia particular en oncología debido a la gran necesidad insatisfecha de nuevas terapias. Las 2 agencias reguladoras más grandes, la Administración de Alimentos y Medicamentos de EE. UU. (FDA) y la Agencia Europea de Medicamentos (EMA), tienen roles globales fundamentales, y sus recomendaciones y aprobaciones son seguidas con frecuencia por otros reguladores nacionales.
Objetivo Comparar las fechas de autorización de comercialización de las nuevas terapias oncológicas aprobadas en EE. UU. y Europa durante la última década y examinar y contrastar las actividades reguladoras de la FDA y la EMA en la aprobación de nuevos medicamentos contra el cáncer.
Diseño, ámbito y participantes Este estudio transversal revisó las bases de datos regulatorias de la FDA y la EMA para identificar nuevas terapias oncológicas aprobadas tanto en los EE. UU. como en Europa entre 2010 y 2019, y la caracterización de los tiempos de las actividades regulatorias. El análisis estadístico se realizó de enero a abril de 2022.
Variables de desenlace y medidas principales Fecha de aprobación regulatoria, tiempo de revisión, presentación de la solicitud de autorización de comercialización, estado de aprobación acelerada o autorización de comercialización condicional y proporción de aprobaciones antes de la publicación revisada por pares de los resultados del ensayo fundamental.
Resultados En total, se aprobaron 89 nuevas terapias oncológicas concomitantes en EE. UU. y Europa entre 2010 y 2019. La FDA aprobó 85 terapias oncológicas (95 %) antes de la autorización europea y 4 terapias (5 %) después. El retraso medio (RIC) en la autorización de comercialización de nuevas terapias oncológicas en Europa fue de 241 (150-370) días en comparación con EE. UU. El tiempo medio de revisión (RIC) fue de 200 (155-277) días para la FDA y de 426 (358-480) días para la EMA. Sesenta y cuatro nuevas solicitudes de licencia (72 %) se enviaron primero a la FDA, en comparación con 21 (23 %) a la EMA. Treinta y cinco terapias oncológicas (39%) fueron aprobadas por la FDA antes de la publicación del estudio fundamental, mientras que solo 8 (9%) por la EMA.
Figura 1. Momento de la aprobación de nuevos medicamentos oncológicos por parte de la Administración de Alimentos y Medicamentos (FDA) de EE. UU. y la Agencia Europea de Medicamentos (EMA)
Figura 2. Tiempo medio de aprobación en días por regulador para terapias contra el cáncer por clase terapéutica
Conclusión y relevancia En este estudio transversal, las nuevas terapias oncológicas se aprobaron antes en EE. UU. que en Europa. La FDA recibió las solicitudes de licencia antes y tuvo tiempos de revisión más cortos. Sin embargo, se aprobaron más terapias antes de la publicación del estudio de licencia, lo que genera incertidumbre para los profesionales con respecto a la utilidad clínica y la seguridad de las terapias recientemente aprobadas.
El estudio original
Lythgoe MP, Desai A, Gyawali B, et al. Cancer Therapy Approval Timings, Review Speed, and Publication of Pivotal Registration Trials in the US and Europe, 2010-2019. JAMA Netw Open. 2022;5(6):e2216183. doi:10.1001/jamanetworkopen.2022.16183