Poca concordancia en los avisos de seguridad de medicamentos publicados por Australia, Canadá, los Estados Unidos y el Reino Unido
JAMA Intern Med., 29 de abril de 2019 Se analizó con qué frecuencia los reguladores de medicamentos en cuatro países (Canadá, los Estados Unidos, el Reino Unido y Australia) emitieron avisos de seguridad sobre los riesgos potenciales de los medicamentos para la salud .Las advertencias varían significativamente según los países
JAMA Intern Med., 29 de abril de 2019.
Las decisiones de las agencias reguladoras nacionales para aprobar nuevos medicamentos se basan en evidencia de seguridad limitada recopilada durante el desarrollo clínico. A menudo, solo cuando un medicamento entra en uso general, se conocen o comprenden mejor los eventos adversos más raros o a largo plazo, lo que incita a los reguladores a emitir avisos de seguridad.1 Examinamos la frecuencia con que los reguladores de medicamentos en 4 países con tradiciones médicas, estado de salud de la población y demografía similares Australia, Canadá, el Reino Unido y los Estados Unidos, fueron concordantes en sus decisiones de emitir avisos de seguridad sobre los medicamentos de venta bajo receta aprobados.
Métodos
Realizamos un análisis retrospectivo de los avisos de seguridad emitidos por la Administración de Medicamentos y Alimentos de los Estados Unidos (FDA), Health Canada (HC), la Agencia Reguladora de Medicamentos y Productos para el Cuidado de la Salud del Reino Unido (MHRA) y la Administración Australiana de Productos Terapéuticos (TGA) desde el 1 de enero. , 2007, al 31 de diciembre de 2016. Los avisos de seguridad se definieron como notificaciones a los prescriptores y / o al público sobre un riesgo potencial o confirmado de medicamentos, excluyendo los problemas de calidad de la producción, escasez o sobredosis. Obtuvimos avisos de los sitios web de los reguladores (actuales y archivados). Este proyecto no estuvo dentro del alcance de la Declaración Nacional sobre Conducta Ética en Investigación Humana porque todos los datos incluidos provienen de documentos disponibles al público. Por lo tanto, de acuerdo con el Código de Conducta de Investigación de la Universidad de Sydney, la aprobación ética no fue requerida.
Cada problema de riesgo de fármacos identificado fue revisado por la concordancia o discordancia entre los reguladores. Las tasas globales de concordancia se calcularon para problemas de riesgo de medicamentos para los cuales al menos 2 países habían emitido un aviso.
El análisis estadístico se realizó desde el 1 de febrero de 2017 hasta el 1 de octubre de 2018. Las tasas de discordancia de los reguladores, definidas como la cantidad de problemas de riesgo de drogas para los cuales cada regulador no emitió un aviso para un medicamento aprobado, se compararon utilizando las pruebas 2 para independencia. Todos los valores de p fueron de pruebas de 2 caras, y los resultados se consideraron estadísticamente significativos con una p <0,05, y se utilizaron correcciones de Bonferroni para comparaciones múltiples.
Resultados
Identificamos 1441 avisos en los 4 países, cubriendo 680 problemas de riesgo de fármacos. La MHRA emitió avisos para 344 de 657 problemas de riesgo de fármacos (52.4%) para medicamentos aprobados en el Reino Unido, HC emitió avisos para 317 de 635 problemas de riesgo de fármacos (49.9%), la FDA emitió avisos para 265 de 647 problemas de riesgo de fármacos (41.0%), y la TGA emitió avisos para 183 de 619 problemas de riesgo de fármacos (29.6%) (Tabla).
La frecuencia general con la que los 4 reguladores emitieron avisos de seguridad difirió significativamente (χ23 = 82.3; P <.001). Fue más probable que el MHRA vs otros reguladores emitiera un aviso (136 de 657 [20.7%] versus FDA, 89 de 647 [13.8%]; HC, 122 de 635 [19.2%]; y TGA, 69 de 619 [11.1% ]; P = .001), mientras que la TGA tenía menos probabilidades de emitir un aviso (P <.001; significado ajustado por Bonferroni, P = .006). La FDA y el HC no difirieron significativamente de las distribuciones esperadas.
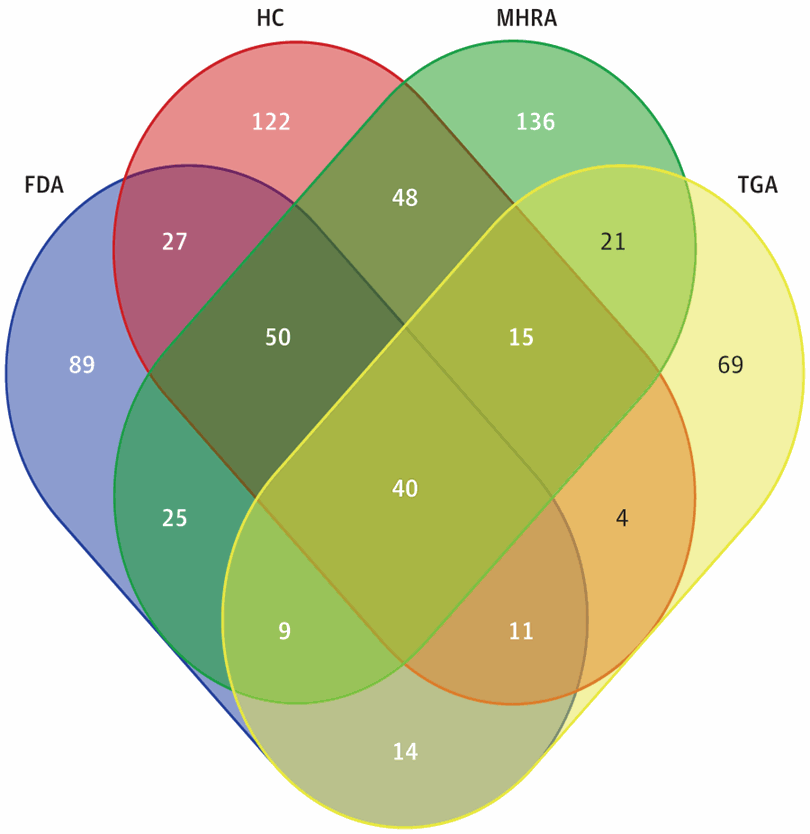
La Tabla muestra una baja tasa de acuerdo en las decisiones para informar a los profesionales y al público sobre inquietudes de seguridad emergentes. El TGA tuvo la tasa de discordancia más alta, sin advertir de 436 de 619 problemas de riesgo de fármacos (70.4%) para medicamentos aprobados en Australia. La MHRA emitió más advertencias, pero aún así no proporcionó advertencias sobre 313 de 657 problemas relevantes de riesgo de fámacos (47.6%). Para 70 de los 680 problemas identificados de riesgo de fármacos (10.3%), los reguladores emitieron avisos en todos los países donde se comercializó el medicamento. Para 40 de 573 problemas de riesgo de fármacos, los 4 países habían aprobado el fármaco y también emitieron avisos (Figura).
Figura Diagrama de Venn que ilustra el nivel de concordancia entre reguladores en la publicación de advertencias de seguridad, 2007-2016
Cada forma indica la cantidad de problemas de riesgo de fármacos para los cuales los reguladores incluidos han emitido avisos (n = 573 problemas de riesgo de drogas para los cuales los 4 reguladores han aprobado el medicamento). El centro (n = 40) indica la situación concordante en la que todos los reguladores emitieron un aviso. FDA indica la Administración de Medicamentos y Alimentos de los Estados Unidos; HC, Health Canada; MHRA, Agencia Reguladora de Medicamentos y Productos Sanitarios del Reino Unido; y TGA, la Administración de Productos Terapéuticos de Australia.
Discusión
En general, encontramos un bajo nivel de concordancia (10.3%) entre los reguladores en la decisión de advertir a los médicos y al público sobre los riesgos de los medicamentos recetados aprobados. Estos resultados sugieren diferencias generalizadas en los patrones de comunicación entre los reguladores incluidos.
Nuestros hallazgos amplían y confirman los resultados de un análisis comparativo de las comunicaciones directas de los profesionales de la salud emitidas por 4 países europeos.2 Ese análisis informó una inconsistencia en las decisiones de emitir avisos, a pesar de que los reguladores nacionales confían en la misma información de la Agencia Europea de Medicamentos.
Este estudio tiene algunas limitaciones. No consideramos avisos fuera de este período de 10 años, y es posible que se hayan emitido algunas advertencias antes o después de este período. Tampoco consideramos otras herramientas de gestión de riesgos que se hayan utilizado para comunicar daños, como la Estrategia de Evaluación y Mitigación de Riesgos de los EE. UU. Sin embargo, un análisis de sensibilidad que incluyó cartas de seguridad enviadas dentro de la Estrategia de Evaluación y Mitigación de Riesgos de los EE. UU. indicó poco efecto en los resultados (57% frente a 59% de tasa de discordancia de la FDA).
Nuestros resultados probablemente reflejan diferencias en los enfoques nacionales de farmacovigilancia. La política nacional de medicamentos determina las actividades del regulador de medicamentos y la disponibilidad de recursos, incluida la capacidad para llevar a cabo el monitoreo posterior a la comercialización y su carga administrativa. 3 Son necesarios estudios adicionales sobre la toma de decisiones y los umbrales de acción de los reguladores 4 (según la gravedad del daño o la evidencia) y los efectos de seguimiento de estas decisiones y acciones, para aclarar completamente las implicaciones de estas políticas para la salud pública.
la carta de investigación
Perry LT, Bhasale A, Fabbri A, et al. Comparative Analysis of Medicines Safety Advisories Released by Australia, Canada, the United States, and the United Kingdom. JAMA Intern Med. Published online April 29, 2019. doi:10.1001/jamainternmed.2019.0294