Transparencia de los ensayos clínicos e intercambio de datos entre las empresas biofarmacéuticas y papel del tamaño de la empresa, ubicación y tipo de producto: un análisis descriptivo transversal
Fue factible aplicar las medidas de transparencia de Good Pharma Scorecard (GPS, una medida sobre qué tan bien las empresas farmacéuticas implementan las buenas prácticas éticas) y la herramienta de clasificación a empresas no grandes y biológicas. Las grandes empresas son significativamente más transparentes que las no grandes, impulsadas por mejores procedimientos de intercambio de datos y la implementación de los requisitos de informes de ensayos de la Ley de Enmiendas de la FDA (FDAAA). Se necesita una mayor transparencia en la investigación, particularmente entre las empresas no grandes, para maximizar los beneficios de la investigación para la atención al paciente y la innovación científica. BMJ Open, 19 de julio de 2021
Objetivos Examinar las características de las empresas asociadas con una mayor transparencia y aplicar una herramienta utilizada para medir y mejorar la transparencia de los ensayos clínicos entre grandes empresas y medicamentos, empresas más pequeñas y productos biológicos.
Diseño Análisis descriptivo transversal.
Ámbito y participantes Nuevos medicamentos y productos biológicos La Administración de Alimentos y Medicamentos (FDA) aprobados en 2016 y 2017 y sus patrocinadores de la empresa.
Variables de desenlace principales: Utilizando las medidas establecidas de Good Pharma Scorecard (GPS), las empresas y los productos fueron evaluados en su registro de ensayos clínicos, difusión de resultados e implementación de la Ley de Enmiendas de la FDA (FDAAA); Las empresas se clasificaron utilizando estas medidas y una medida de intercambio de datos de componentes múltiples. También se examinaron las asociaciones entre las puntuaciones de transparencia de la empresa con el tamaño de la empresa (grande frente a no grande), la ubicación (EE. UU. Versus fuera de EE. UU.) Y el tipo de producto patrocinado (fármaco versus biológico).
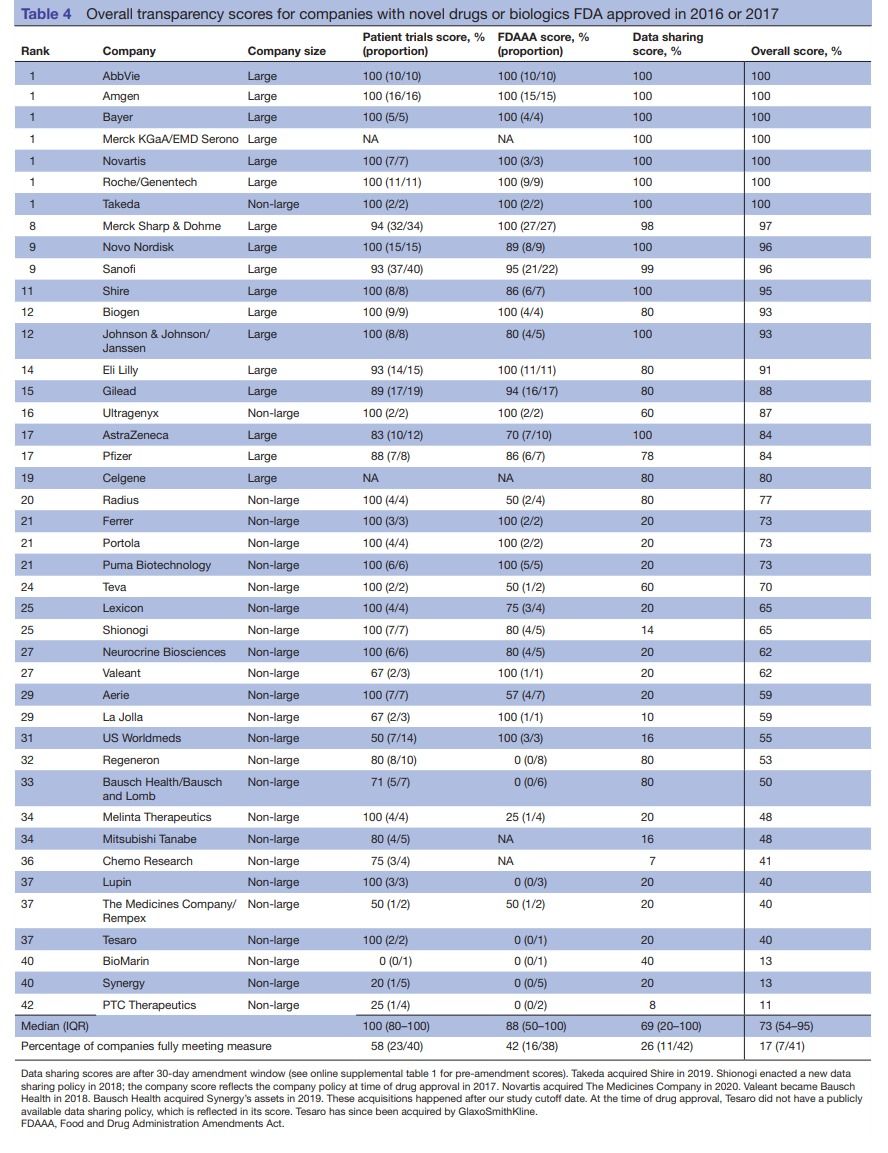
Resultados El 26% de los productos (16/62) tenían resultados disponibles públicamente para todos los ensayos clínicos que respaldaban su aprobación por la FDA y el 67% (39/58) tenían resultados públicos para los ensayos en pacientes 6 meses después de su aprobación por la FDA; El 58% (32/55) cumplió con la FDAAA. Las grandes empresas fueron significativamente más transparentes que las no grandes (puntuación media general de transparencia del 95% (IQR 91-100) frente al 59% (IQR 41-70), p <0,001), atribuible a un mayor cumplimiento de la FDAAA (mediana del 100% (IQR 88-100) frente al 57% (0-100), p = 0,01) y mejor intercambio de datos (mediana del 100% (IQR 80-100) frente al 20% (IQR 20-40), p <0,01). No se observaron diferencias significativas por ubicación de la empresa o tipo de producto.
Conclusiones Fue factible aplicar las medidas de transparencia de Good Pharma Scorecard (GPS, una medida sobre qué tan bien las empresas farmacéuticas implementan las buenas prácticas éticas) y la herramienta de clasificación a empresas no grandes y biológicas. Las grandes empresas son significativamente más transparentes que las no grandes, impulsadas por mejores procedimientos de intercambio de datos y la implementación de los requisitos de informes de ensayos de la FDAAA. Se necesita una mayor transparencia en la investigación, particularmente entre las empresas no grandes, para maximizar los beneficios de la investigación para la atención al paciente y la innovación científica.
el trabajo
Axson S, Mello MM, Lincow D, et al. Clinical trial transparency and data sharing among biopharmaceutical companies and the role of company size, location and product type: a cross-sectional descriptive analysis BMJ Open 2021;11:e053248. doi: 10.1136/bmjopen-2021-053248