Los ensayos de la vacuna COVID 19 deben buscar una eficacia que valga la pena
El mundo necesita una evaluación eficiente, rápida y confiable de muchas vacunas candidatas contra COVID-19. Existe el peligro de que las presiones políticas y económicas para la rápida introducción de una vacuna COVID-19 puedan llevar al despliegue generalizado de una vacuna que en realidad es solo débilmente efectiva (p. Ej., Reducir la incidencia de COVID-19 en solo un 10-20%), quizás debido a un resultado engañosamente prometedor de un ensayo con poca potencia. Lancet , 27 de agosto de 2020
Tres cuestiones son cruciales en la planificación de los ensayos de la vacuna COVID-19: (1) si se debe exigir no solo una prueba de la eficacia de la vacuna, sino también una prueba de una eficacia valiosa; (2) si los ensayos iniciales de la vacuna contra el placebo deben priorizar no solo los ensayos de una sola vacuna sino también un ensayo de múltiples vacunas; y (3) si se debe evaluar la seguridad, la protección contra enfermedades graves y la duración de la protección mediante un seguimiento ciego continuo de los grupos de vacuna y placebo después de que haya surgido evidencia definitiva de eficacia a corto plazo, pero antes de que se haya implementado localmente una vacuna eficaz en la población general.
El mundo necesita una evaluación eficiente, rápida y confiable de muchas vacunas candidatas contra COVID-19. Existe el peligro de que las presiones políticas y económicas para la rápida introducción de una vacuna COVID-19 puedan llevar al despliegue generalizado de una vacuna que en realidad es solo débilmente efectiva (p. Ej., Reducir la incidencia de COVID-19 en solo un 10-20%), quizás debido a un resultado engañosamente prometedor de un ensayo con poca potencia. El despliegue de una vacuna débilmente eficaz en realidad podría empeorar la pandemia de COVID-19 si las autoridades asumen erróneamente que causa una reducción sustancial del riesgo, o si las personas vacunadas creen erróneamente que son inmunes, lo que reduce la implementación o el cumplimiento de otras medidas de control de COVID-19. El despliegue de una vacuna de eficacia marginal también podría interferir con la evaluación de otras vacunas, ya que las vacunas posteriores tendrían que compararse con ella en lugar de con un placebo. Para una vacuna superior a la vacuna débilmente eficaz, el mayor tamaño de muestra requerido podría retrasar el reconocimiento de su eficacia. Más importante aún, si la vacuna débil se compara con una vacuna aún más débil, los criterios estadísticos utilizados para analizar los ensayos de no inferioridad bien podrían respaldar la vacuna aún más débil como no inferior (el llamado bio-creep) .1
Por lo tanto, los criterios utilizados para definir una vacuna exitosa en los ensayos clínicos iniciales de vacunación versus placebo deben ser lo suficientemente estrictos como para proteger contra el riesgo de que se implemente una vacuna débilmente efectiva, especialmente porque ya hay muchas vacunas candidatas contra COVID-19 para probar. , 2 proporcionando muchas oportunidades para sobrestimar la eficacia. Por lo tanto, los ensayos iniciales que comparan las vacunas COVID-19 con el placebo deben buscar evidencia confiable no solo de cierta eficacia sino de una eficacia valiosa.
La OMS recomienda que las vacunas exitosas muestren una reducción del riesgo estimada de al menos la mitad, 3 con suficiente precisión para concluir que la verdadera eficacia de la vacuna es superior al 30%. Esto significa que el IC del 95% para el resultado del ensayo debería excluir una eficacia inferior al 30%. La guía actual de la Administración de Medicamentos y Alimentos de EE. UU. Incluye este límite inferior del 30% como criterio para la autorización de vacunas.4
Como ejemplo de un resultado que solo satisfaría estos dos criterios, un ensayo aleatorio uniforme con 50 casos en los vacunados y 100 casos en los que recibieron placebo tendría un IC del 95% que solo excluye el 30%, pero sugeriría un 50% eficacia a corto plazo. Una vacuna que tenga un 50% de eficacia podría reducir considerablemente la incidencia de COVID-19 en personas vacunadas y podría proporcionar una útil inmunidad colectiva. Por tanto, aunque una eficacia mucho mayor del 50% sería mejor, una eficacia de aproximadamente el 50% representaría un progreso sustancial.
En comparación con los ensayos individuales para cada una de las muchas vacunas diferentes, un ensayo mundial de múltiples vacunas con un grupo de control compartido podría proporcionar resultados más rápidos y confiables. Además, su uso continuo de la infraestructura de ensayos clínicos establecida podría ahorrar tiempo y esfuerzo, acelerando el descubrimiento necesario de varias vacunas seguras y efectivas. Las altas tasas de inscripción facilitadas por un diseño de ensayo flexible y cientos de sitios de estudio en lugares de alta incidencia podrían producir resultados sobre la eficacia a corto plazo de cada vacuna en tan solo unos meses de incluir esa vacuna.
También se necesitan pruebas fiables sobre la eficacia a largo plazo, la seguridad de las vacunas y la protección contra el COVID-19 grave. Se necesitan ensayos de suficiente tamaño y duración para proporcionar esto y para determinar si la vacuna puede hacer que COVID-19 sea más peligroso (el llamado aumento de la enfermedad) .5, 6
Los ensayos que evalúan solo criterios de valoración inmunológicos no pueden proporcionar esta evidencia, y los estudios de provocación en humanos en voluntarios adultos jóvenes, por lo demás sanos, podrían no proporcionar evidencia suficiente de seguridad o eficacia en otras poblaciones. Las evaluaciones de seguridad en los ensayos de múltiples vacunas pueden determinar directamente si determinadas vacunas tienen efectos adversos que no comparten otras vacunas. La evaluación de múltiples vacunas COVID-19 con metodología estandarizada facilitará las decisiones regulatorias y de implementación.7
A menos que tales decisiones estén informadas por evidencia aleatoria confiable, el efecto sobre la aceptación pública de las vacunas COVID-19 podría afectar negativamente el control de COVID-19 y la aceptación de vacunas contra otras enfermedades.8
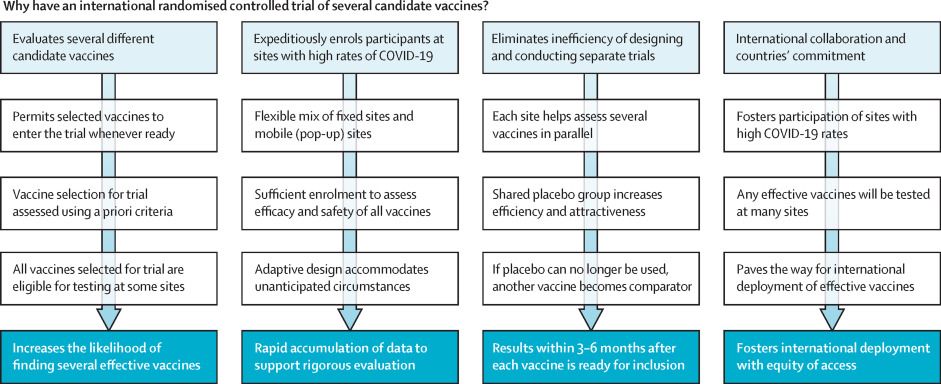
El ensayo de vacunas Solidarity de la OMS9 (figura) tiene como objetivo evaluar de manera eficiente y rápida (dentro de los 3 a 6 meses posteriores a la introducción de cada vacuna en el estudio) la eficacia de múltiples vacunas, 10 ayudando a garantizar que no se utilicen vacunas de eficacia débil. El ensayo busca lograr resultados rápidos y confiables mediante la simplicidad del diseño del ensayo además de verificaciones en tiempo real de la calidad de la cantidad limitada de datos buscados, lo que facilita altas tasas de reclutamiento. Un desafío importante con los ensayos de vacunas en sitios de estudio fijos es que las tasas de ataque inesperadamente bajas pueden retrasar el progreso. El ensayo de la OMS mitigará esto mediante la diversidad geográfica, reclutando en muchos países de alta incidencia a través de sitios de investigación fijos y móviles (emergentes) en localidades donde hay tasas sustanciales de ataque de COVID-19 en el momento de la inscripción.
Para una vacuna de una o dos dosis que reduce a la mitad el riesgo, el resultado principal sobre la eficacia a corto plazo debería surgir en un plazo de 3 a 6 meses, a menos que en los análisis intermedios surjan resultados definitivos para una vacuna altamente eficaz. El seguimiento controlado con placebo luego continúa hasta al menos el mes 12, o hasta que se implemente localmente una vacuna eficaz. Este enfoque aumenta la confiabilidad de la evidencia en adultos jóvenes y mayores, la duración de la protección, la eficacia contra la enfermedad grave y cualquier mejora de la enfermedad.
Financiadores, desarrolladores de vacunas, investigadores e instituciones gubernamentales11 han firmado una declaración internacional de colaboración en la investigación de vacunas. Varios de estos desarrolladores y más de 250 sitios de investigación tienen la intención de unirse al Ensayo de Vacunas Solidarias de la OMS con la esperanza de adelantar el momento en que el mundo avanzará más allá de la enfermedad generalizada, la muerte y la interrupción de la pandemia COVID-19. Los costos del ensayo serán una fracción de los costos sociales de COVID-19, y esta colaboración global podría refutar el nihilismo perjudicial de las vacunas y el nacionalismo de las vacunas.
Todos participamos en la redacción del protocolo para el ensayo de vacunas solidarias de la OMS y no declaramos otros intereses en competencia. Este comentario refleja las opiniones de los autores y no debe interpretarse como que representa las opiniones o políticas de la Administración de Drogas y Alimentos de los EE. UU.
El editorial original
Philip Krause, Thomas R Fleming, Ira Longini, Ana Maria Henao-Restrepo, Richard Peto for theWorld Health Organization Solidarity Vaccines Trial Expert Group † COVID-19 vaccine trials should seek worthwhile efficacy Published: August 27, 2020DOI:https://doi.org/10.1016/S0140-6736(20)31821-3