Posible impacto negativo de las decisiones de Agencias reguladoras reputadas sobre el estado de aprobación de nuevos medicamentos contra el cáncer en los países de América Latina
Los países de América Latina siguen aprobando nuevos medicamentos contra el cáncer, a menudo basándose en ensayos clínicos mal realizados que miden criterios de valoración sustitutos. La EMA y otros reguladores de renombre deben ser conscientes de que sus decisiones regulatorias pueden influir directamente en las decisiones relativas a la autorización de comercialización, los presupuestos de salud y la atención del paciente en otros lugares. PLoS ONE 13 de julio de 2021
Antecedentes
Muchos medicamentos nuevos contra el cáncer están siendo aprobados por autoridades reguladoras de renombre sin evidencia de beneficio de supervivencia general, mejora de la calidad de vida y, a menudo, se basan en ensayos clínicos con alto riesgo de sesgo. En los últimos años, la mayoría de los países de América Latina (LA) han reformado sus reglas de autorización de comercialización (MA) para aceptar o abreviar directamente el proceso de aprobación en caso de autorización previa por parte, principalmente, de la Agencia Europea de Medicamentos (EMA) y la Administración de Alimentos y Medicamentos de EE. UU.. Este estudio evaluó el impacto potencial de las decisiones tomadas por la EMA con respecto a la aprobación de nuevos medicamentos contra el cáncer basándose en ninguna evidencia de supervivencia general o en ensayos clínicos potencialmente sesgados en países de Los Ángeles.
Diseño Análisis descriptivo.
Àmbito Bases de datos de autorización de comercialización de acceso público de los reguladores de Los Ángeles, Informe de evaluación pública europea de la EMA y estudios anteriores que acceden a las aprobaciones de la EMA de nuevos medicamentos contra el cáncer 2009-2016.
Variables de desenlace y medidas principales
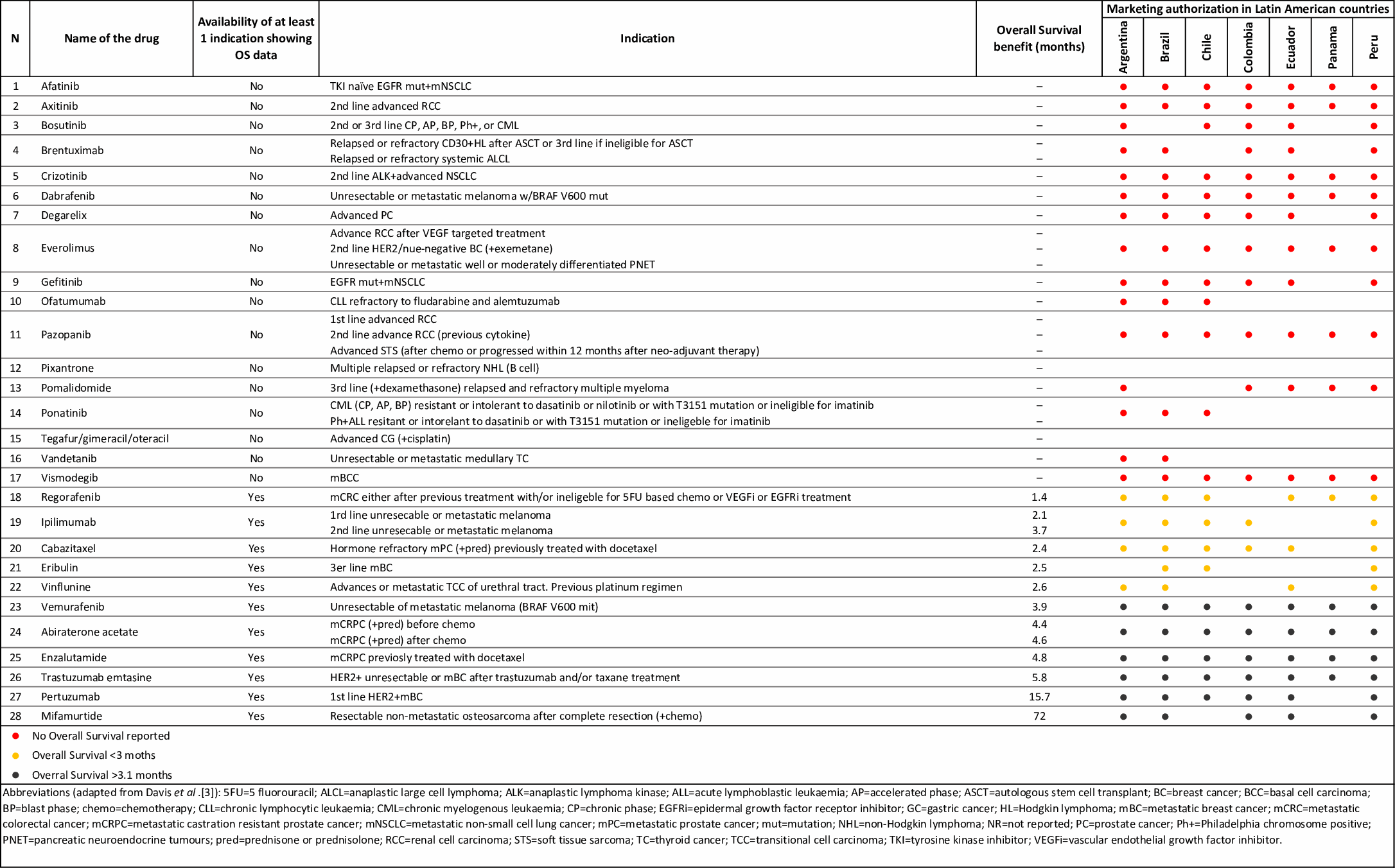
Número de nuevos medicamentos contra el cáncer aprobados por países de AL sin evidencia de supervivencia general (2009-2013) y sin al menos un ensayo clínico calificado con bajo riesgo de sesgo, o sin ningún ensayo que respalde la autorización de comercialización (2014-2016).
Resultados
Argentina, Brasil, Chile, Colombia, Ecuador, Panamá y Perú tienen bases de datos de MA confiables y accesibles al público y fueron incluidos. De los 17 medicamentos contra el cáncer aprobados por la EMA (2009-2013) sin evidencia de beneficio de SG después de una mediana de tiempo posterior a la comercialización de 5,4 años, 6 reguladores de LA aprobaron más del 70% de ellos. De los 13 fármacos aprobados por la EMA (2014-2016), sin ensayo de apoyo o sin ensayo de bajo riesgo de sesgo, Brasil aprobó 11, Chile 10, Perú 10, Argentina 10, Colombia 9, Ecuador 9 y Panamá 8.
Conclusiones
Los países de América Latina siguen aprobando nuevos medicamentos contra el cáncer, a menudo basándose en ensayos clínicos mal realizados que miden criterios de valoración sustitutos. La EMA y otros reguladores de renombre deben ser conscientes de que sus decisiones regulatorias pueden influir directamente en las decisiones relativas a la autorización de comercialización, los presupuestos de salud y la atención del paciente en otros lugares.
El trabajo
Carlos E. Durán, Martín Cañás, Martín Urtasun, Monique Elseviers, Robert Vander Stichele, Thierry Christiaens . Potential negative impact of reputed regulators’ decisions on the approval status of new cancer drugs in Latin American countries: A descriptive analysis. PLoS One. 2021 Jul 13;16(7):e0254585. doi: 10.1371/journal.pone.0254585
Ver También