Inmunogenicidad y reactogenicidad de la vacuna de refuerzo BNT162b2 (BioNTech-Pfizer) en participantes preparados con ChAdOx1-S (AstraZeneca).Estudio CombiVacS
BNT162b2 administrada como segunda dosis en individuos vacunados con ChAdOx1-S induce una respuesta inmune robusta, con un perfil de reactogenicidad aceptable y manejable.Lancet, 25 de junio de2021
Antecedentes: Hasta la fecha, no se han reportado datos inmunológicos sobre esquemas de vacunación heteróloga de COVID-19 en humanos. Se evaluó la inmunogenicidad y reactogenicidad de BNT162b2 (Comirnaty, BioNTech, Mainz, Alemania) administrada como segunda dosis en participantes preparados con ChAdOx1-S (Vaxzevria, AstraZeneca, Oxford, Reino Unido).
Métodos: Hicimos un ensayo de fase 2, abierto, aleatorizado y controlado en adultos de 18 a 60 años, vacunados con una dosis única de ChAdOx1-S 8-12 semanas antes de la detección y sin antecedentes de infección por SARS-CoV-2. Los participantes fueron asignados al azar (2: 1) para recibir BNT162b2 (0,3 ml) mediante una única inyección intramuscular (grupo de intervención) o continuar la observación (grupo de control). El resultado primario fue la inmunogenicidad de 14 días, medida mediante inmunoensayos para la proteína de pico trimérica del SARS-CoV-2 y el dominio de unión al receptor (RBD). La funcionalidad del anticuerpo se evaluó usando una prueba de neutralización de pseudovirus y la respuesta inmune celular usando un inmunoensayo de interferón-γ. El resultado de seguridad fue la reactogenicidad a los 7 días, medida como los eventos adversos locales y sistémicos solicitados. El análisis primario incluyó a todos los participantes que recibieron al menos una dosis de BNT162b2 y que tuvieron al menos una evaluación de eficacia después del inicio. El análisis de seguridad incluyó a todos los participantes que recibieron BNT162b2. Este estudio está registrado en EudraCT (2021-001978-37) y ClinicalTrials.gov (NCT04860739) y está en curso.
Resultados: Entre el 24 y el 30 de abril de 2021, se inscribieron 676 personas y se asignaron aleatoriamente al grupo de intervención (n = 450) o al grupo de control (n = 226) en cinco hospitales universitarios de España (edad media 44 años [DE 9]; 382 [57%] mujeres y 294 [43%] hombres). 663 (98%) participantes (n = 441 intervención, n = 222 control) completaron el estudio hasta el día 14. En el grupo de intervención, los títulos de media geométrica de anticuerpos RBD aumentaron de 71,46 BAU / mL (95% CI 59,84-85,33) al inicio del estudio a 7756,68 BAU / mL (7371,53–8161,96) en el día 14 (p <0,0001). La IgG contra la proteína de pico trimérica aumentó de 98,40 BAU / mL (95% CI 85,69–112,99) a 3684,87 BAU / mL (3429,87–3958,83). La intervencionista: la proporción de control fue 77,69 (95% CI 59,57–101,32) para la proteína RBD y 36,41 (29,31–45,23) para la proteína IgG de pico trimérico. Las reacciones fueron leves (n = 1.210 [68%]) o moderadas (n = 530 [30%]), con dolor en el lugar de la inyección (n = 395 [88%]), induración (n = 159 [35%]), cefalea (n = 199 [44%]) y mialgia (n = 194 [43%]) los eventos adversos notificados con mayor frecuencia. No hubo eventos graves reportados.
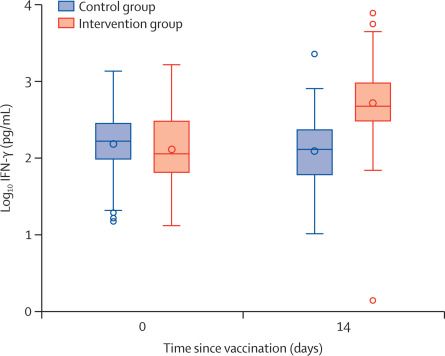
Concentraciones de IFN-γ medidas en los grupos de intervención y control en los días 0 y 14. IFN = interferón. * p <0 · 0001.
Interpretación: BNT162b2 administrada como segunda dosis en individuos vacunados con ChAdOx1-S induce una respuesta inmune robusta, con un perfil de reactogenicidad aceptable y manejable.
El trabajo
Alberto M Borobia et al. Immunogenicity and reactogenicity of BNT162b2 booster in ChAdOx1-S-primed participants (CombiVacS): a multicentre, open-label, randomised, controlled, phase 2 trial. Lancet :June 25, 2021DOI:https://doi.org/10.1016/S0140-6736(21)01420-3