Seguridad y eficacia de una vacuna COVID-19 basada en vectores rAd26 y rAd5, Gam-COVID-Vac (Sputnik V) : análisis intermedio del ensayo de fase 3
Este análisis intermedio del ensayo de fase 3 de Gam-COVID-Vac mostró una eficacia del 91,6% contra COVID-19 y fue bien tolerado en una gran cohorte. Resumen, editorial acompañante y nota de prensa. Lancet 2 de febrero de 2021
Una vacuna basada en adenovirus recombinante heterólogo (rAd), Gam-COVID-Vac (Sputnik V), mostró un buen perfil de seguridad e indujo fuertes respuestas inmunes humorales y celulares en los participantes de los ensayos clínicos de fase 1/2. Aquí, informamos los resultados preliminares sobre la eficacia y seguridad de Gam-COVID-Vac del análisis intermedio de este ensayo de fase 3.
Métodos
Hicimos un ensayo de fase 3 aleatorizado, doble ciego, controlado con placebo en 25 hospitales y policlínicos en Moscú, Rusia. Se incluyeron participantes de al menos 18 años, con pruebas de PCR y IgG e IgM de SARS-CoV-2 negativas, sin enfermedades infecciosas en los 14 días anteriores a la inscripción y sin otras vacunas en los 30 días anteriores a la inscripción. Los participantes fueron asignados al azar (3: 1) para recibir la vacuna o el placebo, con una estratificación por grupo de edad. Los investigadores, los participantes y todo el personal del estudio fueron enmascarados a la asignación de grupo. La vacuna se administró (0,5 ml / dosis) por vía intramuscular en un régimen de estimulación inicial y refuerzo: un intervalo de 21 días entre la primera dosis (rAd26) y la segunda dosis (rAd5), ambos vectores portadores del gen de la glicoproteína S del SARS-CoV-2 de longitud completa. El resultado principal fue la proporción de participantes con COVID-19 confirmado por PCR desde el día 21 después de recibir la primera dosis. Todos los análisis excluyeron a los participantes con violaciones del protocolo: el resultado primario se evaluó en los participantes que habían recibido dos dosis de vacuna o placebo, los eventos adversos graves se evaluaron en todos los participantes que habían recibido al menos una dosis en el momento del bloqueo de la base de datos y los efectos adversos raros Los eventos se evaluaron en todos los participantes que habían recibido dos dosis y para quienes se verificaron todos los datos disponibles en el formulario de informe de casos en el momento del bloqueo de la base de datos. El ensayo está registrado en ClinicalTrials.gov (NCT04530396).
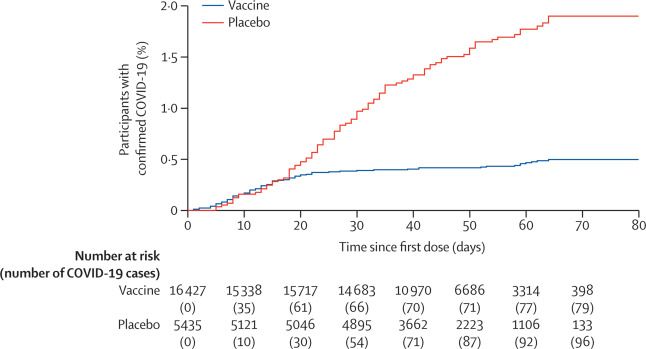
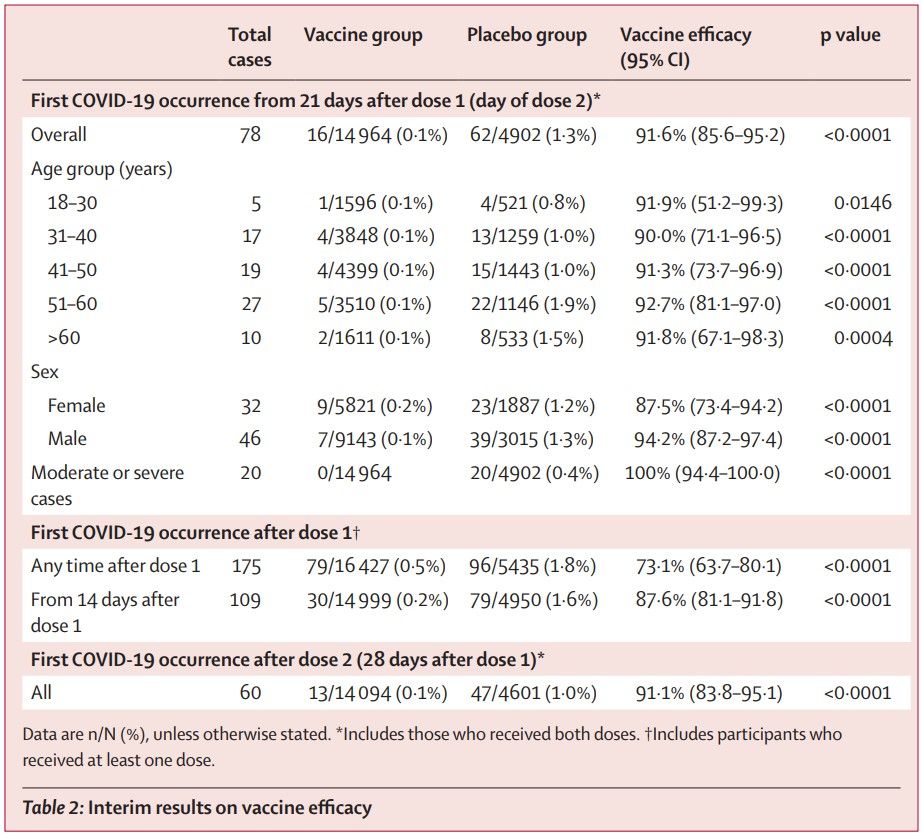
Resultados Entre el 7 de septiembre y el 24 de noviembre de 2020, 21 977 adultos fueron asignados al azar al grupo de la vacuna (n = 16 501) o al grupo placebo (n = 5476). 19 866 recibieron dos dosis de vacuna o placebo y se incluyeron en el análisis de resultado primario. Desde 21 días después de la primera dosis de vacuna (el día de la dosis 2), se confirmó que 16 (0,1%) de 14 964 participantes en el grupo de vacuna y 62 (13%) de 4902 en el grupo de placebo tenían COVID-19; la eficacia de la vacuna fue del 91,6% (IC del 95%: 85,6–95,2). La mayoría de los eventos adversos notificados fueron de grado 1 (7485 [94 · 0%] de 7966 eventos totales). 45 (0,3%) de 16 427 participantes en el grupo de la vacuna y 23 (0,4%) de 5435 participantes en el grupo de placebo tuvieron eventos adversos graves; ninguno se consideró asociado con la vacunación, con la confirmación del comité de seguimiento de datos independiente. Se informaron cuatro muertes durante el estudio (tres [<0,1%] de 16 427 participantes en el grupo de vacuna y una [<0,1%] de 5435 participantes en el grupo de placebo), ninguna de las cuales se consideró relacionada con la vacuna.
Interpretación
Este análisis intermedio del ensayo de fase 3 de Gam-COVID-Vac mostró una eficacia del 91,6% contra COVID-19 y fue bien tolerado en una gran cohorte.
El ensayo
Denis Y Logunov, Inna V Dolzhikova, Dmitry V Shcheblyakov, et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. The Lancet , Published:February 02, 2021 DOI: https: //doi.org/10.1016/S0140-6736 (21) 00234-8
el editorial acompañante
El candidato a vacuna Sputnik V COVID-19 parece seguro y eficaz
Lancet, 2 de febrero de 2021 DOI:
Denis Logunov y colegas1 informan sus resultados provisionales de un ensayo de fase 3 de la vacuna Sputnik V COVID-19 en The Lancet. Los resultados del ensayo muestran un fuerte efecto protector consistente en todos los grupos de edad de los participantes. También conocida como Gam-COVID-Vac, la vacuna utiliza un enfoque de adenovirus recombinante heterólogo que utiliza adenovirus 26 (Ad26) y adenovirus 5 (Ad5) como vectores para la expresión del pico de coronavirus 2 (SARS-CoV-2) del síndrome respiratorio agudo severo proteína. El uso de dos serotipos diferentes, que se administran con 21 días de diferencia, está destinado a superar cualquier inmunidad de adenovirus preexistente en la población.
Entre las principales vacunas COVID en desarrollo hasta la fecha, solo Gam-COVID-Vac utiliza este enfoque; otros, como la vacuna Oxford-AstraZeneca, utilizan el mismo material para ambas dosis. La vacuna anterior para la enfermedad por el virus del Ébola, también desarrollada en el Centro Nacional de Investigación de Epidemiología y Microbiología de Gamaleya (Moscú, Rusia), era similar, con Ad5 y el virus de la estomatitis vesicular como virus portadores, 3 y el principio general de impulso primario con dos vectores diferentes se ha utilizado ampliamente de forma experimental.4
La ruta de protección del adenovirus recombinante se comparte con la vacuna Oxford-AstraZeneca, que utiliza un adenovirus de chimpancé (ChAdOx), 5 la vacuna Johnson & Johnson que usa solo Ad266 cuyos resultados detallados se esperan pronto, y la vacuna basada en Ad5 del Instituto de Biotecnología de Beijing CanSinoBIO, cuyo ensayo de fase 3 comenzó en septiembre de 2020.7
Los virus portadores se modifican y no pueden iniciar una infección productiva; entran en las células, expresan la proteína de pico y luego se detienen (porque no pueden continuar el ciclo de vida normal del virus), aunque un análisis de alta sensibilidad también mostró que algunos genes Ad se expresaron, aunque en un nivel bajo.8
Las células infectadas por la vacuna son finalmente destruidas por la misma inmunidad que están diseñadas para provocar. Los adenovirus recombinantes se han utilizado ampliamente como vectores de vacunas porque pueden acomodar grandes cargas genéticas y, aunque no pueden replicarse, activan los sensores de inmunidad innata lo suficiente como para garantizar un compromiso robusto del sistema inmunológico.9
En consecuencia, no necesitan un adyuvante y pueden proporcionar inmunidad después de una sola dosis.
Se cree que su robustez física permite el almacenamiento a temperaturas de alrededor de –18 ° C, lo que es factible para muchas cadenas de suministro. La desventaja de las vacunas basadas en adenovirus recombinantes es que se requieren grandes dosis, por lo general de 1010 o 1011 partículas, lo que plantea grandes demandas en la fabricación y cuantificación necesarias para su implementación a escala mundial.
Entonces, ¿qué hay de los datos de la vacuna Sputnik V COVID-19 publicados aquí?
Los datos anteriores de la fase 1/2 publicados en septiembre de 2020 mostraron resultados de seguridad prometedores y dieron una indicación de que la respuesta inmunitaria estaba en un nivel consistente con la protección.10
Los receptores generaron sólidas respuestas de anticuerpos a la proteína de pico, que incluían anticuerpos neutralizantes, la proporción de la inmunoglobulina total que inhibe la unión del virus a su receptor. También mostraron evidencia de respuestas de células T, consistente con una respuesta inmune que no debería disminuir rápidamente.
El informe provisional de los datos de la fase 3 ahora presentado1 incluye los resultados de más de 20 000 participantes, el 75% de los cuales fueron asignados para recibir la vacuna, y el seguimiento de eventos adversos e infecciones. Con un poder de estudio planificado del 85%, los reclutados tenían 18 años o más, alrededor del 60% eran hombres y casi todos eran blancos. Las comorbilidades, un riesgo conocido de gravedad de COVID-19, estuvieron presentes en aproximadamente una cuarta parte de los que ingresaron al ensayo. 62 (13%) de 4902 personas en el grupo de placebo y 16 (0,1%) de 14964 participantes en el grupo de vacuna habían confirmado la infección por SARS-CoV-2 desde el día 21 después de la primera dosis de vacuna (el resultado primario) .
La curva de Kaplan Meier de la tasa de incidencia en los dos grupos mostró que la inmunidad requerida para prevenir la enfermedad surgió dentro de los 18 días de la primera dosis. Esa protección se aplica a todos los grupos de edad, incluidos los mayores de 60 años, y las historias de casos anecdóticos de los vacunados pero infectados sugieren que la gravedad de la enfermedad disminuye a medida que se desarrolla la inmunidad. Se produjeron tres muertes en el grupo de la vacuna en individuos con comorbilidades extensas y se consideró que no estaban relacionadas con la vacuna.
No se registraron eventos adversos graves considerados relacionados con la vacuna, pero se informaron eventos adversos graves no relacionados con la vacuna en 45 participantes del grupo de vacuna y 23 participantes del grupo placebo. La eficacia de la vacuna, basada en el número de casos confirmados de COVID-19 a partir de 21 días después de la primera dosis de vacuna, se informa como 91.6% (IC 95% 85.6-95.2) y la disminución sugerida de la gravedad de la enfermedad después de una dosis es particularmente alentador para las estrategias actuales de ahorro de dosis.
El editorial
Ian Jones, Polly RoySputnik V COVID-19 vaccine candidate appears safe and effective. The Lancet Published: February 02, 2021DOI:https://doi.org/10.1016/S0140-6736(21)00191-4
Gacetilla de prensa 2 de febrero de 2021
Una vacuna para toda la humanidad: la eficacia de la vacuna Sputnik V en la lucha contra el Covid-19 ha sido validada por datos revisados por pares a nivel internacional y publicados en The Lancet
· En un análisis intermedio de un ensayo clínico de fase III, Sputnik V mostró resultados sólidos en cuanto a eficacia, inmunogenicidad y seguridad.
· La eficacia de la vacuna Sputnik V contra el COVID-19 fue del 91,6%.
o El análisis incluyó datos de 19 866 voluntarios, que recibieron tanto la primera como la segunda dosis de la vacuna Sputnik V, o su placebo, en el punto de control final, de 78 casos confirmados de COVID-19.
o La eficacia en el grupo de edad avanzada, de 2 144 voluntarios mayores de 60 años, fue del 91,8% y no difirió estadísticamente del grupo de 18 a 60 años.
· Sputnik V proporciona una protección total contra casos graves de COVID-19.
· Entre los casos analizados, más del 98% de los voluntarios desarrollaron una respuesta inmunitaria humoral y el 100%, una respuesta inmune celular.
· El nivel de anticuerpos neutralizantes del virus en voluntarios vacunados con Sputnik V es 1,3-1,5 veces mayor que el nivel de anticuerpos de los pacientes que se recuperaron del COVID-19.
· Excelente perfil de seguridad. La mayoría de los eventos adversos (94%) fueron leves e incluyeron síntomas pseudogripales, reacciones en el lugar de la inyección, dolor de cabeza y astenia.
o No se produjeron eventos adversos graves asociados con la vacunación, tal como confirmó el Comité Independiente de Monitoreo de Datos.
o Sin alergias fuertes, sin shock anafiláctico.
· Sputnik V es una de las tres vacunas del mundo con una eficacia superior al 90%. Además, Sputnik V destaca entre estas vacunas gracias a una serie de ventajas clave:
o Basada en una plataforma de vectores adenovirales humanos, los cuales han demostrado ser seguros durante décadas de uso.
o Fácil distribución en todo el mundo: temperatura de almacenamiento de entre dos y ocho grados centígrados.
o Una de las vacunas más asequibles del mundo, con un coste de menos de $10 por inyección.
· La vacuna Sputnik V ya ha sido registrada en 16 países: Rusia, República de Belarús, Serbia, Argentina, Bolivia, Argelia, Palestina, Venezuela, Paraguay, Turkmenistán, Hungría, Emiratos Árabes Unidos, Irán, la República de Guinea, Túnez y Armenia.
· En la primera semana de febrero, comenzará la vacunación con Sputnik V en los siguientes 12 países: Bolivia, Kazajistán, Turkmenistán, Palestina, Emiratos Árabes Unidos, Paraguay, Hungría, Armenia, Argelia, la República Serbia de Bosnia, Venezuela e Irán.
o En 10 países de 12, Sputnik V será la primera vacuna contra el coronavirus aprobada para su circulación civil.
Moscú, 2 de febrero de 2021 – El Centro Nacional de Investigación en Epidemiología y Microbiología Gamaleya del Ministerio de Salud de la Federación de Rusia y el Fondo Ruso de Inversión Directa (RDIF, el fondo soberano de Rusia) anuncian que The Lancet, una de las revistas médicas más antiguas y respetadas del mundo, ha publicado los resultados intermedios de un ensayo clínico de fase III de la vacuna Sputnik V, el cual confirma la alta eficacia y seguridad de la vacuna. Sputnik V, basada en una plataforma de vectores adenovirales humanos bien estudiada, es la primera vacuna registrada en el mundo contra el coronavirus.
En el análisis intermedio de eficacia del ensayo clínico, aleatorizado, de doble ciego y controlado por placebo, los datos de 19 866 voluntarios fueron incluidos el análisis de eficacia (14 964 de los cuales recibieron la vacuna y 4 902 el placebo), las dos dosis de Sputnik V, administradas con 21 días de diferencia, demostraron una eficacia del 91,6% contra el COVID-19. El cálculo se basa en el análisis de 78 casos confirmados de COVID-19 identificados en el grupo de placebo (62 casos) y en el grupo que recibió la vacuna (16 casos). Sputnik V generó una sólida respuesta inmunitaria humoral y celular.
Alexander Gintsburg, director del Centro de Investigación en Epidemiología y Microbiología Gamaleya, dijo:
“La publicación de los datos, revisados por pares a nivel internacional, con los resultados de los ensayos clínicos del Sputnik V es un gran éxito en la batalla global contra la pandemia de COVID-19. La seguridad y la alta eficacia de la vacuna rusa se demuestran con los sólidos datos científicos presentados. Felicito a todo el equipo del Centro Nacional de Investigación Gamaleya por este logro monumental. Ya se han creado varias vacunas basadas en adenovirus humanos y esta herramienta es una de las más prometedoras para el desarrollo de nuevas vacunas en el futuro ”.
Kirill Dmitriev, director ejecutivo del Fondo Ruso de Inversión Directa, comentó:
“Este es un gran día en la lucha contra la pandemia de COVID-19. Los datos publicados por The Lancet demuestran no sólo que Sputnik V es la primera vacuna registrada del mundo, sino también una de las mejores. Protege completamente contra casos severos de COVID-19, de acuerdo con los datos que han sido compilados y revisados de forma independiente por pares y publicados en The Lancet. Sputnik V es una de las tres vacunas en el mundo con una eficacia superior al 90%, pero supera a éstas en términos de seguridad, facilidad de transporte, ya que almacena a una temperatura de +2 a +8 grados, y un precio más asequible. Sputnik V es una vacuna para toda la humanidad ”.
Dra. Hildegund C.J. Ertl., Profesora, Centro de Vacunas e Inmunoterapia, The Wistar Institute, EE. UU., Dijo:
“La vacuna es 100% efectiva para prevenir enfermedades graves o muertes, que al final es el parámetro más crucial; todos podemos lidiar con los estornudos siempre y cuando permanezcamos fuera del hospital o del cementerio. Incluso después de una sola dosis del régimen de refuerzo, la protección conferida contra la enfermedad fue del 87,6%. Por tanto, Sputnik V es más eficaz que las vacunas de AstraZeneca o Johnson & Johnson. La vacuna Sputnik V, la cual, a diferencia de las vacunas de ARN igualmente eficaces de Pfizer y Moderna, se puede almacenar en el refrigerador, será de gran valor para combatir la pandemia mundial de COVID-19 ".
Dr. Cecil Czerkinsky, PhD, Director de Investigación, Instituto Nacional de Salud e Investigación Médica (Inserm), Francia, dijo:
“Los resultados intermedios del ensayo clínico de fase 3 de la vacuna contra el COVID de vector adenoviral Sputnik V son bastante impresionantes. Esta vacuna parece ser muy eficaz e inmunogénica en todos los grupos de edad. Es claramente una buena noticia, ya que esta vacuna de formulación dual es comparativamente fácil de fabricar y desplegar en un contexto de escasez anticipada de vacunas a nivel mundial y de problemas logísticos en el despliegue de las vacunas recientemente autorizadas para uso de emergencia, las cuales son sensibles a la temperatura".
Omar Sued, presidente de la Sociedad de Infectólogos de Argentina, dijo:
“El artículo, publicado en The Lancet, confirma los resultados exitosos y proporciona información adicional sobre la eficacia y seguridad de esta vacuna en diferentes subgrupos. Desde el punto de vista de la salud pública, la eficacia de la vacuna fue muy alta. El perfil de seguridad fue muy bueno. La difusión de esta información es vital para informar sobre la ampliación y el despliegue de esta vacuna en todo el mundo ".
David Livermore, profesor de microbiología médica en la Universidad de East Anglia, Reino Unido, dijo:
“Actualmente, el mundo necesita todas las buenas vacunas que pueda recibir contra COVID-19. Y estos son resultados impresionantes: Sputnik V es la primera vacuna de vector de adenovirus que alcanza el 90% de eficacia observada en las dos vacunas de ARNm ”.
Len Seymour, profesor de terapias genéticas en el Departamento de Oncología de la Universidad de Oxford, Reino Unido, comentó:
“Los datos indican una actividad alentadora en la vacuna Sputnik V, incluso en una cohorte con participantes de 60 o más años. Este es uno de los primeros estudios en utilizar dos vectores diferentes para los dos estadios de vacunación, una estrategia diseñada para maximizar la respuesta inmune contra el antígeno del COVID-19. Representa un desarrollo impresionante y una contribución importante a la lucha mundial contra el COVID-19 ”.
Según los resultados del estudio revisado por pares, la vacuna proporciona una protección completa contra casos graves de la nueva infección por coronavirus. Se registraron 20 casos graves confirmados de COVID-19 en el grupo de placebo, mientras que no se registró ninguno en el grupo de vacuna. Debido al tiempo necesario para generar la respuesta inmune, en la primera semana después de la vacunación no hubo diferencia significativa en la protección contra casos severos de COVID-19 entre los grupos de vacuna y placebo, mientras que en un período de 7 a 14 días la eficacia de la vacuna se elevó al 50%, al 74,1% en el período de 14 a 21 días y al 100% a partir del día 21, brindando una protección completa contra casos graves de coronavirus.
Es importante destacar que el estudio incluyó a 2 144 voluntarios mayores de 60 años, con edades máximas de 87 años (grupo vacunado) y 84 años (grupo de placebo), mostrando excelentes resultados de seguridad para los estratos de edad avanzada. La eficacia de la vacuna para las personas de edad avanzada fue del 91,8% y no difirió estadísticamente del grupo de 18 a 60 años, demostrando también grandes resultados de seguridad e inmunogenicidad.
Sputnik V ha demostrado un excelente perfil de seguridad: se registraron 70 episodios de eventos adversos graves (EAG) no relacionados con el COVID-19 en 68 participantes del estudio: en 45 voluntarios del grupo vacunado y 23 voluntarios del grupo de placebo. Ninguno de estos eventos se asoció con la vacunación, tal como ha confirmado el Comité Independiente de Monitoreo de Datos. La mayoría de los eventos adversos (94%) fueron leves y se limitaron a síntomas pseudogripales, reacciones en el lugar de la inyección, dolor de cabeza y astenia.
Sputnik V es una de las tres únicas vacunas en el mundo que ha demostrado una eficacia superior al 90%. Sputnik V destaca entre estas vacunas gracias a una serie de ventajas clave: un mecanismo de vector adenoviral humano bien estudiado y altamente eficaz, que ha demostrado además ser seguro durante décadas; el bajo costo de la vacuna en comparación con otros enfoques; y menores requisitos logísticos, ya que la temperatura de almacenamiento es de entre dos y ocho grados Celsius, lo que permite una distribución más sencilla en todo el mundo.
La seguridad de las vacunas basadas en adenovirus humanos ha sido confirmada en más de 75 publicaciones internacionales y más de 250 ensayos clínicos realizados durante las últimas dos décadas, mientras que la historia del uso de adenovirus humanos en el desarrollo de vacunas se remonta a 1953. Los vectores adenovirales son virus de la gripe común que han sido modificados genéticamente para que no se puedan reproducir en el cuerpo humano. Cuando se usa la vacuna Sputnik V, no es el coronavirus en sí el que entra en el cuerpo, ya que la vacuna sólo contiene información genética sobre una parte de su capa de proteína externa, los llamados "picos" que forman su corona. Esto elimina por completo la posibilidad de infectarse como resultado de la vacunación y al mismo tiempo hace que el cuerpo genere una respuesta inmune estable.
Además, Sputnik V usa dos vectores diferentes, basados en los serotipos de adenovirus humanos Ad5 y Ad26, en dos inyecciones separadas, lo que permite una defensa más eficaz contra el coronavirus que las vacunas que usan el mismo vector para ambas inyecciones. Al desplegar dos vectores diferentes, Sputnik V evita un posible efecto neutralizante y genera una respuesta inmune a largo plazo más duradera.