Farmacología
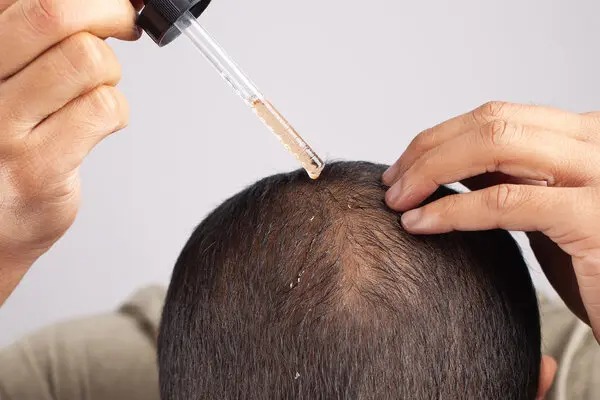
Inicio de tratamiento oral con minoxidil a dosis bajas para pacientes con pérdida de cabello: Declaración de consenso internacional Delphi modificada
26 marzo 2025
Esta declaración de consenso internacional de expertos sobre la prescripción no autorizada de minoxidil para pacientes con pérdida de cabello puede servir de guía en la práctica clínica hasta que surjan más datos. Los expertos en pérdida de cabello con experiencia en el tratamiento de pacientes pediátricos estuvieron subrepresentados en este panel de expertos. Las investigaciones futuras deberían investigar las mejores prácticas para el uso de minoxidil en pacientes pediátricos. Otros temas críticos para mayor investigación incluyen la eficacia comparativa del minoxidil tópico frente al oral, la seguridad del oral en pacientes con antecedentes de dermatitis alérgica de contacto al minoxidil tópico, la seguridad a largo plazo del minoxidil y el uso de otras presentaciones no autorizadas de minoxidil, como las formulaciones magistrales de minoxidil oral y sublingual. A medida que surjan más datos basados en la evidencia, estas recomendaciones deberán actualizarse. JAMA Dermatol 2025

Flutamida: casos graves de hepatotoxicidad asociados al uso fuera de las condiciones autorizadas
28 abril 2017
