Consecuencias regulatorias y clínicas de los ensayos confirmatorios negativos de medicamentos contra el cáncer de aprobación acelerada
Las indicaciones de medicamentos contra el cáncer que recibieron una aprobación acelerada a menudo permanecieron en el etiquetado formal de medicamentos aprobados por la FDA y continuaron recomendándose en las guías clínicas varios años después de que los ensayos posteriores a la aprobación requeridos por ley no mostraran una mejoría en el criterio de valoración de eficacia primario. Las guías clínicas deben alinearse mejor con los resultados de los ensayos posteriores a la aprobación de medicamentos contra el cáncer que recibieron una aprobación acelerada. BMJ, 9 de septiembre de 2021
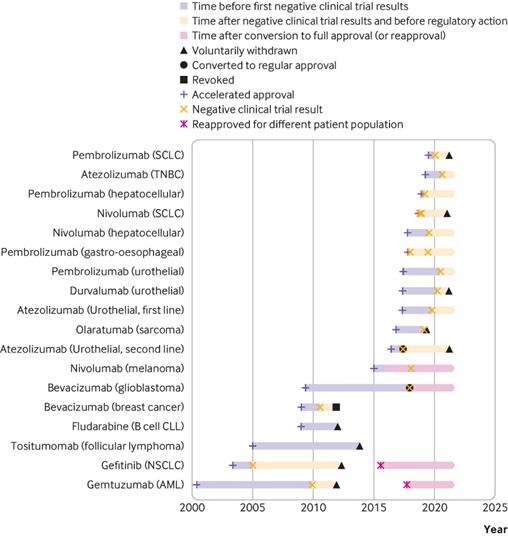
Objetivos Investigar el manejo regulatorio de los medicamentos contra el cáncer que recibieron la aprobación acelerada de la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) pero que no lograron mejorar el criterio de valoración primario en los ensayos posteriores a la aprobación y evaluar en qué medida los ensayos negativos posteriores a la aprobación cambiaron las recomendaciones en las pautas de tratamiento.
Diseño Estudio observacional retrospectivo.
Ambito informes de la FDA y la Red Nacional Integral del Cáncer (NCCN).
Medicamentos incluidos Medicamentos contra el cáncer que recibieron la aprobación acelerada de la FDA y tuvieron ensayos negativos posteriores a la aprobación.
Variables de desenlace principales Resultados regulatorios, incluido el retiro, la conversión a aprobación regular y la no acción.
Resultados Se identificaron 18 indicaciones para 10 medicamentos contra el cáncer que recibieron una aprobación acelerada pero que no mejoraron el criterio de valoración primario en los ensayos posteriores a la aprobación. De estos, 11 (61%) fueron retirados voluntariamente por el fabricante y uno (bevacizumab para el cáncer de mama) fue revocado por la FDA. De los 11 retiros, seis ocurrieron solo en 2021. Las seis indicaciones restantes (33%) permanecen en el etiquetado. Las directrices de la NCCN proporcionan un alto nivel de respaldo (endoso de categoría 1 para uno y endoso de categoría 2A para siete) para medicamentos de aprobación acelerada que han fallado en los ensayos posteriores a la aprobación, a veces incluso después de que la aprobación haya sido retirada o revocada.
Conclusión Las indicaciones de medicamentos contra el cáncer que recibieron una aprobación acelerada a menudo permanecieron en el etiquetado formal de medicamentos aprobados por la FDA y continuaron recomendándose en las guías clínicas varios años después de que los ensayos posteriores a la aprobación requeridos por ley no mostraran una mejoría en el criterio de valoración de eficacia primario. Las guías clínicas deben alinearse mejor con los resultados de los ensayos posteriores a la aprobación de medicamentos contra el cáncer que recibieron una aprobación acelerada.
el trabajo
Gyawali B, Rome B N, Kesselheim A S. Regulatory and clinical consequences of negative confirmatory trials of accelerated approval cancer drugs: retrospective observational study BMJ 2021; 374 :n1959 doi:10.1136/bmj.n1959
Ver También
Aprobación acelerada | Farmacología | Fundación Femeba (fundacionfemeba.org.ar)