Farmacología

Predictores de retirada de indicaciones de fármacos contra el cáncer con aprobación acelerada
02 junio 2025
Las aprobaciones aceleradas basadas en datos preliminares que sugieren un beneficio clínico limitado tienden a presentar tasas de abandono más altas, mientras que las terapias con la designación de Terapia Innovadora y mecanismos dirigidos al genoma tienen mayor probabilidad de validar los beneficios clínicos y obtener una aprobación regular. Los pacientes y los profesionales sanitarios deben considerar estos factores al evaluar las terapias con aprobación acelerada. eClinicalMedicine, 31 de mayo de 2025.

Tiempo hasta la aprobación total o el retiro de medicamentos contra el cáncer que recibieron aprobación acelerada por parte de la FDA
09 abril 2025
Este estudio de cohorte de 102 indicaciones de medicamentos oncológicos aprobados en forma acelerada entre 1992 y 2022 y que se convirtieron en aprobación regular para agosto de 2024, el bajo beneficio clínico o las preocupaciones de seguridad en la aprobación acelerada se asociaron con un retraso en la aprobación regular, lo que debería ser una señal de precaución para los pacientes y oncólogos que consideren su uso. JAMANetwork Open, 26 de marzo de 2025.

Variables subrogadas y aprobación acelerada de medicamentos ¿Hacia la inversión de la carga de la prueba?
04 febrero 2025
Las variables subrogadas requieren de una adecuada validación para acreditar su utilidad. No obstante, las autoridades sanitarias admiten variables con un nivel de exigencia progresivamente menor. Las aprobaciones aceleradas precisan de estudios confirmatorios que, con frecuencia, no se completan. Se identifican inconsistencias en variables empleadas en el abordaje del cáncer, demencia, osteoporosis y patologías infecciosas o cardiovasculares. El acceso prematuro a las terapias farmacológicas puede repercutir en una mayor incidencia de reacciones adversas con escaso margen para implementar estrategias de mitigación de daños. El abandono del ensayo clínico en beneficio de diseños de corte predictivo u observacional, compromete la calidad de la evidencia obtenida. Bol Inf Farmacoter Navar, 31 de enero de 2025
Medicamentos de alto costo: el difícil equilibrio entre los derechos individuales y los derechos colectivos
15 agosto 2024
En este artículo se recorre la temática de los medicamentos de alto precio y se incorpora al debate el contexto sanitario, cultural, jurídico, político y económico que la rodea. Rev Panam Salud Publica, 5 de agosto de 2024
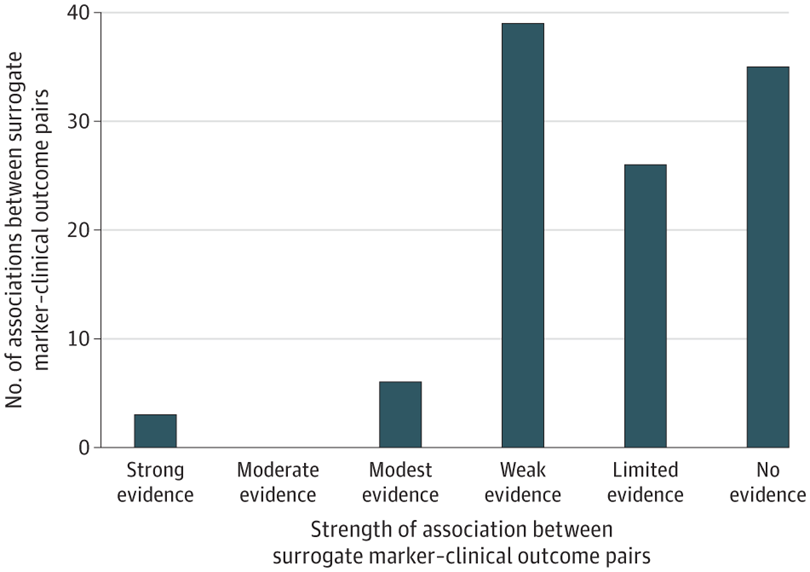
Asociaciones entre marcadores sustitutos y resultados clínicos para tratamientos de enfermedades crónicas no oncológicas
28 mayo 2024
