Sospechas de reacciones adversas notificadas con tratamientos utilizados en COVID-19
Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), está realizando un seguimiento estrecho de las sospechas de reacciones adversas notificadas con fármacos considerados estrategias terapéuticas potenciales para la infección de SARS-CoV-21. Los medicamentos que se están revisando son los siguientes: remdesivir, lopinavir/ ritonavir, hidroxicloroquina, cloroquina, tocilizumab, sarilumab, ruxolitinib, siltuximab, baricitinib, anakinra, interferón beta-1B e interferón alfa-2B. AEMPS, 22 de mayo de 2020
documento completo en https://bit.ly/3c31hPO
- Contenido, interpretación y presentación de los datos
- Casos de sospechas de reacciones adversas notificados en España con tratamientos para COVID-19
- Arritmias cardíacas
- Trastornos psiquiátricos
- Trastornos hepáticos
- Trastornos hematológicos
- Trastornos renales
- Pancreatitis
- Recomendaciones para la notificación de sospechas de reacciones adversas a medicamentos para el tratamiento de la COVID-19
- Autores
- Bibliografía
Contenido, interpretación y presentación de los datos
El Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H), integrado por los Centros Autonómicos de Farmacovigilancia y coordinado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), está realizando un seguimiento estrecho de las sospechas de reacciones adversas notificadas con fármacos considerados estrategias terapéuticas potenciales para la infección de SARS-CoV-21. Los medicamentos que se están revisando son los siguientes: remdesivir, lopinavir/ ritonavir, hidroxicloroquina, cloroquina, tocilizumab, sarilumab, ruxolitinib, siltuximab, baricitinib, anakinra, interferón beta-1B e interferón alfa-2B.
La base de datos de sospechas de reacciones adversas, denominada FEDRA, recoge todos los casos que los profesionales sanitarios o la ciudadanía notifica en España, bien sea a través de su centro autonómico de farmacovigilancia, o a través de la industria farmacéutica. FEDRA no recoge casos procedentes de ensayos clínicos. El principal objetivo de la notificación de sospechas de reacciones adversas a medicamentos (RAM) es el de servir como sistema ágil y rápido de identificación de posibles reacciones adversas no identificadas previamente, o cambios en la forma de presentación de reacciones adversas ya conocidas.
En la actualidad no hay ningún tratamiento autorizado indicado para la COVID-19. Se están empleando moléculas de nuevo desarrollo (ej. remdesivir) o medicamentos autorizados en otras indicaciones, algunos de ellos con pautas de administración diferentes a las autorizadas (ej. hidroxicloroquina). Adicionalmente las características basales de los pacientes con COVID-19 difieren de las de aquellos otros que utilizan estos fármacos en sus indicaciones autorizadas, pudiendo afectar también al perfil de reacciones adversas de estos fármacos en dichos pacientes. En esta situación, la información de seguridad disponible es muy escasa, siendo de gran importancia generar de manera precoz información sobre la seguridad de estos tratamientos.
En las notificaciones de sospecha de reacción adversa, NO hay certeza de que el fármaco sospechoso haya causado la reacción adversa.
La acumulación de los casos notificados NO puede ser utilizada para calcular la incidencia o para estimar la probabilidad de aparición de reacciones adversas del medicamento.
La evaluación global de todos los casos notificados de una asociación medicamento-reacción tiene como objetivo únicamente la identificación de potenciales riesgos no conocidos o de cambios en la forma de presentación de las reacciones adversas ya conocidas.
Casos de sospechas de reacciones adversas notificados en España con tratamientos para COVID-19
Hasta el 17 de mayo de 2020 se han registrado en FEDRA un total de 182 casos de sospechas de reacciones adversas en pacientes con COVID-19 tratados con los fármacos objeto de seguimiento.
De los 182 casos, 168 (92%) han sido notificados directamente a los Centros Autonómicos de Farmacovigilancia y el 8% restante a través de la industria farmacéutica. La mayoría han sido comunicados por profesionales sanitarios (175 casos, 96%) y 9 casos (5%) proceden de estudios. De los 182 casos, 115 proceden de un hospital con un sistema de farmacovigilancia activa que revisa resultados analíticos para detectar posibles reacciones adversas, lo que explica que algunas reacciones adversas estén sobrerrepresentadas como ocurre en los trastornos hepáticos. La mayoría de los pacientes eran adultos (63%) o mayores de 65 años (36%). El 79% de los casos corresponden a varones.
Generalmente los pacientes con COVID-19 reciben combinaciones de varios medicamentos y se pueden considerar sospechosos de haber producido la reacción adversa a todos ellos, sólo a algunos o incluso a otros medicamentos que el paciente estuviera tomando.
De los casos notificados, hidroxicloroquina aparece registrado como medicamento sospechoso en 145 casos, tocilizumab en 55, lopinavir/ritonavir en 51, remdesivir en 5, interferón beta 1B en 4, cloroquina en 3, baricitinib en 1 y anakinra en otro caso. No se han recibido notificaciones con interferón alfa 2B, ruxolitinib, sarilumab ni siltuximab. Cabe esperar que los fármacos que más se administran sean los más notificados por lo que un mayor número de casos notificados no es indicativo de mayor riesgo.
La tabla 1 muestra la distribución de los casos para los medicamentos en seguimiento en los que constaba COVID-19 como indicación terapéutica, incluyendo sus combinaciones más frecuentes. Además de estos medicamentos en seguimiento, esta tabla incluye la azitromicina dado que se emplea frecuentemente junto con la hidroxicloroquina. Cabe destacar que también otros fármacos que tomaba el paciente se han considerado en algunos casos sospechosos de haber producido la reacción; estos no se incluyen en la tabla y los más frecuentes han sido ceftriaxona (45 casos), enoxaparina (14 casos), levofloxacino (8 casos) y paracetamol (8 casos).
|
Fármacos sospechosos utilizados en COVID-19 |
Casos Notificados |
|---|---|
|
Hidroxicloroquina + Azitromicina |
40 |
|
Hidroxicloroquina |
34 |
|
Hidroxicloroquina + Azitromicina + Tocilizumab |
28 |
|
Lopinavir/ritonavir |
18 |
|
Hidroxicloroquina + Lopinavir/ritonavir |
14 |
|
Hidroxicloroquina + Tocilizumab |
13 |
|
Hidroxicloroquina + Azitromicina + Lopinavir/ritonavir |
9 |
|
Tocilizumab |
8 |
|
Remdesivir |
4 |
|
Hidroxicloroquina + Azitromicina + Lopinavir/ritonavir + Tocilizumab |
3 |
|
Otros |
11 |
|
TOTAL |
182 |
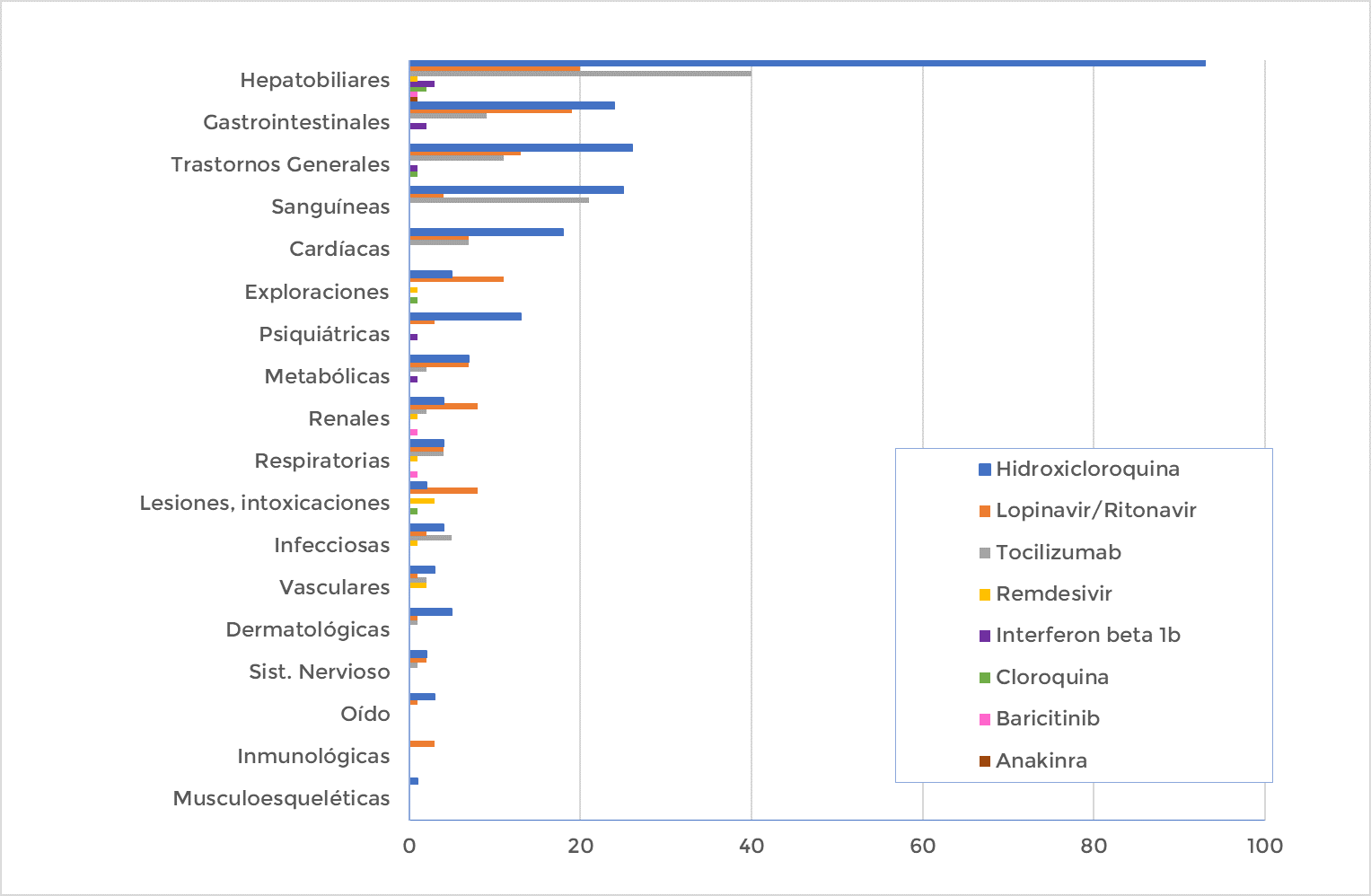
De los 182 casos registrados en este periodo, 172 son graves2 (95%), ya que la notificación de los mismos es prioritaria frente a los casos menos graves. En ellos se describen 333 términos de sospechas de reacciones adversas. Hay que tener en cuenta que un caso puede incluir más de una sospecha de reacción adversa. En la figura 1 se muestra la distribución de todas las sospechas de reacciones adversas agrupadas por órgano o sistema incluidas en las notificaciones para cada uno de los fármacos en seguimiento cuando se han utilizado para el tratamiento de la COVID-19.
Gráfica 1: Distribución de las reacciones adversas notificadas por órgano o sistema para cada fármaco en seguimiento utilizado para el manejo de la COVID-19.
documento completo en https://bit.ly/3c31hPO