Evaluación de nuevas entidades moleculares aprobadas para el tratamiento del cáncer en 2020
La FDA aprobó más nuevas entidades moleculares (NEM) para el cáncer en 2020 que en 2019. Sin embargo, la mayoría de las NEM aprobadas se basaron en criterios de valoración sustitutos con efectos inciertos sobre la supervivencia y la calidad de vida.5 La mayoría de las aprobaciones se basaron en ensayos clínicos no controlados de un solo brazo y requerirán pruebas de eficacia posteriores a la comercialización. JAMA Netw Open, 28 de mayo de 2021
Introducción
La pandemia de COVID-19 ha provocado interrupciones sin precedentes en los ensayos y el desarrollo de fármacos.1 La Administración de Alimentos y Medicamentos de EE. UU. (FDA) ha tenido que gastar sus recursos en la revisión de terapias y vacunas contra el SARS-CoV-2.2 A pesar de estos desafíos, el comisionado de la FDA ha declaró que la FDA está “a toda velocidad” en 2020 en la aprobación de nuevos medicamentos contra el cáncer.3 Para evaluar esta afirmación, buscamos examinar todas las nuevas entidades moleculares (NEM) aprobadas para el tratamiento del cáncer en 2020.
Métodos
En este estudio transversal, revisamos el sitio web de aprobaciones de hematología / oncología de la FDA4 para determinar todos los medicamentos de hematología / oncología aprobados en 2020. Los autores (CS y VP) determinaron qué medicamentos eran nuevos, definidos como sin aprobación previa de la FDA para un medicamento similar. o indicación diferente. Las nuevas formulaciones de medicamentos aprobados previamente (p. Ej., Formulaciones orales de formulaciones intravenosas aprobadas anteriormente) no se consideraron medicamentos nuevos. Registramos la tasa de respuesta, la tasa de respuesta completa, la duración de la respuesta, la supervivencia sin progresión y la supervivencia general según lo informado en la información de prescripción de la FDA para cada fármaco. En el caso de que una aprobación dada se basara en dos ensayos diferentes o dos brazos separados de un ensayo, se registró la respuesta media entre los dos ensayos. Se anotó el tipo de aprobación de la FDA (acelerada o regular) y el diseño del ensayo. Las aprobaciones aceleradas requieren más pruebas de eficacia para mejorar la supervivencia general o libre de progresión.
Este estudio no se presentó para la aprobación de la junta de revisión institucional porque no usó información de atención médica personal y todos los datos del estudio están disponibles públicamente (Regla común, 82 FR §7149) .4 Este informe sigue a la guía de informes para estudios transversales, de las guías de Fortalecimiento de los informes de estudios observacionales en epidemiología (STROBE, por su sigla en inglés).
Resultados
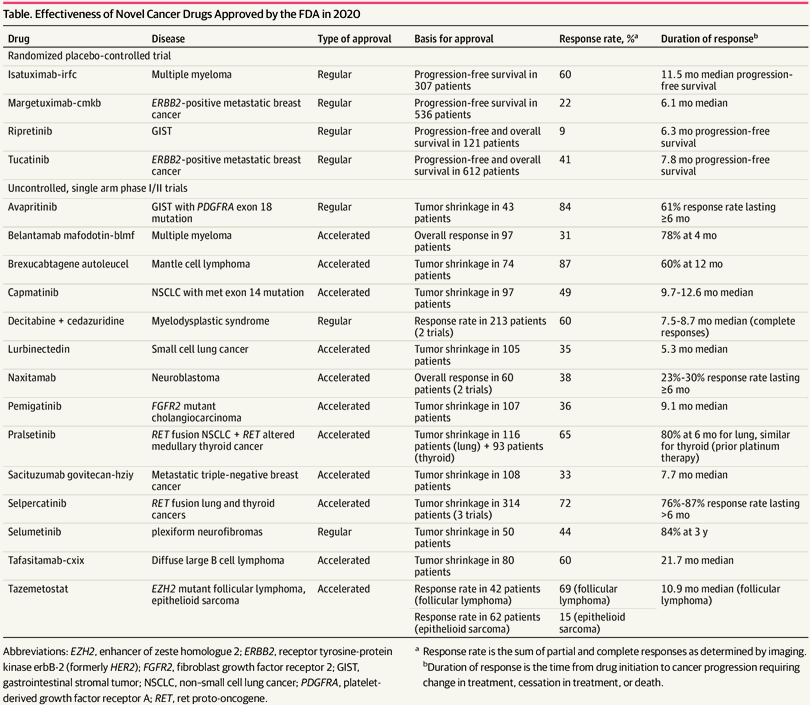
Se aprobaron 18 NEM para el tratamiento del cáncer en 2020, según lo determinado por los autores (Tabla). Esto fue más que las 13 NEM aprobadas para el cáncer en 2019, y similar a 2018.4
Se aprobaron dos fármacos (11%) sobre la base de una mejora en la supervivencia general en comparación con un brazo controlado con placebo. Estos incluyen ripretinib, que en el ensayo tuvo una supervivencia global de 15,1 meses en el tumor del estroma gastrointestinal metastásico en comparación con una supervivencia de 6,6 meses para los pacientes que recibieron placebo, y tucatinib, que cuando se utilizó en combinación con capecitabina y trastuzumab resultó en una supervivencia global media de 21,9 meses en el cáncer de mama metastásico ERBB2 (antes HER2) positivo en comparación con 17,4 meses en el grupo de capecitabina y trastuzumab. Las 16 aprobaciones de nuevos fármacos contra el cáncer restantes se basaron en la tasa de respuesta o la supervivencia libre de progresión. De todas las nuevas terapias contra el cáncer aprobadas en 2020, la tasa de respuesta media (es decir, tasa de respuesta parcial más completa) fue del 49,7% (rango, 9% -87%); la tasa de respuesta completa osciló entre el 0% y el 62%, con una mediana del 3% (figura).
Solo 4 (22%) de las aprobaciones se basaron en un ensayo aleatorio controlado con placebo. Las 14 aprobaciones restantes (78%) se basaron en ensayos no controlados de fase I / II de un solo brazo. Once de estas fueron aprobaciones aceleradas y requerirán más datos de eficacia.
Discusión
La FDA aprobó más NEM para el cáncer en 2020 que en 2019. Sin embargo, la mayoría de las NEM aprobadas se basaron en criterios de valoración sustitutos con efectos inciertos sobre la supervivencia y la calidad de vida.5 La mayoría de las aprobaciones se basaron en ensayos clínicos no controlados de un solo brazo y requerirán pruebas de eficacia posteriores a la comercialización.6 Aproximadamente la mitad de los pacientes que reciben uno de estos nuevos medicamentos aprobados en 2020 tendrán una respuesta tumoral demostrable. Los autores reconocen que este estudio es limitado porque solo revisamos 1 año de aprobaciones de medicamentos por la FDA. Además, los datos de ensayos futuros con respecto a estos medicamentos pueden estar disponibles, lo que hace que las observaciones aquí ya no sean relevantes.
El artículo
Smith CEP, Prasad V. Assessment of New Molecular Entities Approved for Cancer Treatment in 2020. JAMA Netw Open. 2021;4(5):e2112558. doi:10.1001/jamanetworkopen.2021.12558