FDA permite que los medicamentos sin un beneficio clínico comprobado permanezcan durante años en la vía acelerada
"El proceso actual, que permite que los medicamentos estén en el mercado con una base de evidencia tan baja, envía señales equivocadas a otras compañías farmacéuticas, que asumirán que también pueden obtener aprobación con poca evidencia". BMJ 30 de julio de 2021
Las críticas al proceso de aprobación acelerada de la Administración de Medicamentos y Alimentos de los Estados Unidos han resurgido después de la reciente aprobación de aducanumab (Aduhelm) para la demencia. Elisabeth Mahase encuentra que el proceso está plagado de datos de eficacia faltantes y evidencia cuestionable
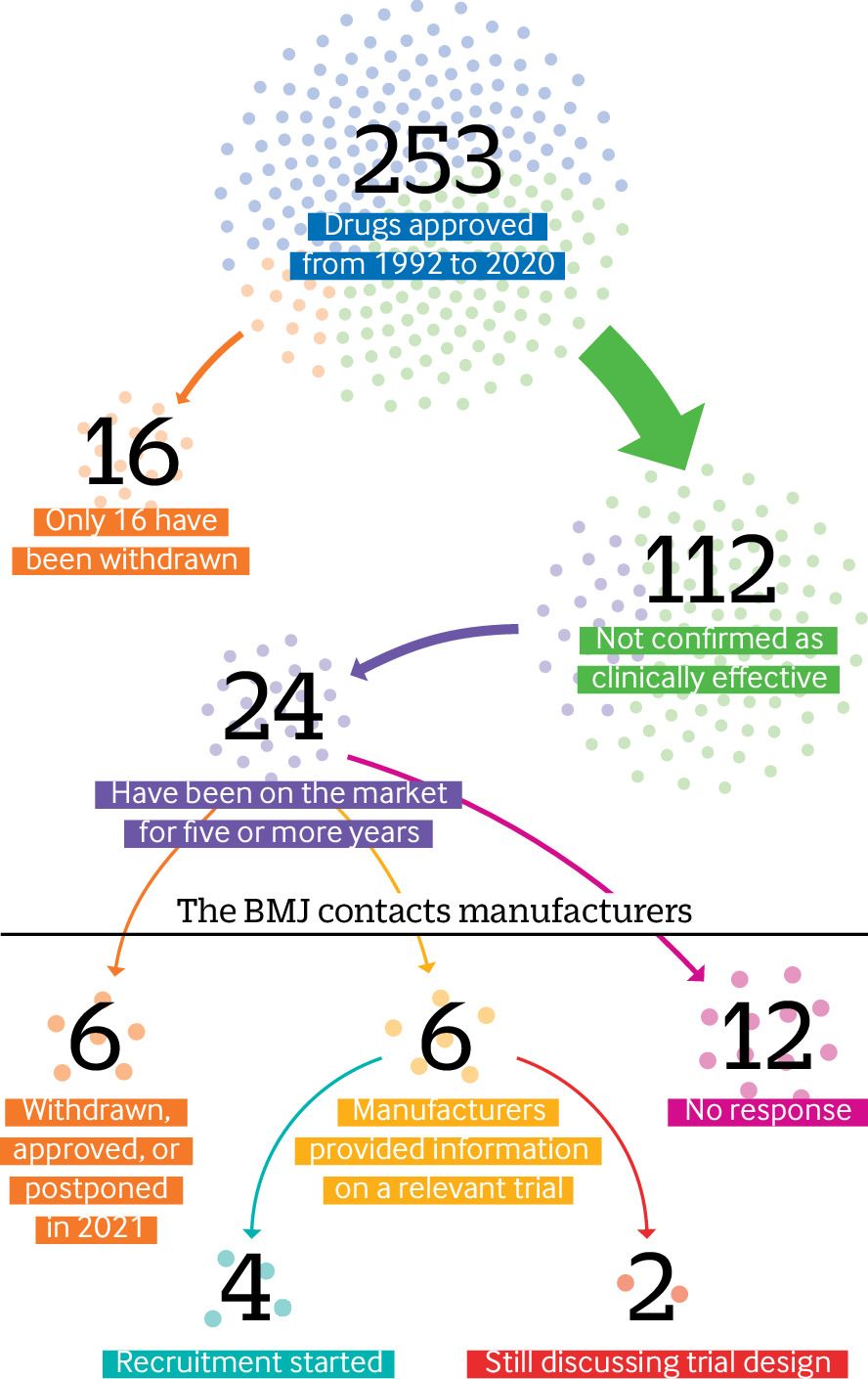
Desde que la Administración de Medicamentos y Alimentos de EE. UU. estableció su vía de aprobación acelerada de medicamentos en 1992, casi la mitad (112) de los 253 medicamentos autorizados no han sido confirmados como clínicamente efectivos, según encontró una investigación de The BMJ.
De estos 112 medicamentos aprobados en los últimos 28 años, un quinto (24) ha estado en el mercado durante más de cinco años y algunos durante más de dos décadas, a menudo con un precio elevado, muestra un análisis en profundidad de los datos de la FDA1 al 31 de diciembre de 2020, realizado por The BMJ.
La vía acelerada permite que los medicamentos salgan al mercado antes de que se haya demostrado su eficacia. Sin embargo, como parte de esta aprobación, el fabricante debe realizar estudios posteriores a la aprobación, conocidos como ensayos confirmatorios de fase IV, para "verificar el beneficio clínico anticipado". Si estos ensayos no muestran ningún beneficio, se puede cancelar la aprobación del medicamento.
Un análisis más detallado de los datos de la FDA muestra que solo se han retirado 16 medicamentos aprobados a través de la vía. Se demostró que la mayoría de ellos carecían de eficacia, pero en algunos casos los ensayos confirmatorios nunca se realizaron. Celecoxib (Celebrex), que recibió una aprobación acelerada en 1999 para el tratamiento de la poliposis adenomatosa familiar, estuvo en el mercado durante 12 años antes de que la FDA finalmente le pidiera a Pfizer que lo retirara voluntariamente para esta indicación porque los ensayos de eficacia nunca se realizaron.2
El BMJ preguntó a los fabricantes de 24 tratamientos que han estado en el mercado durante más de cinco años si habían realizado ensayos de fase IV. Se retiraron, aprobaron o pospusieron seis fármacos. De los 18 fármacos restantes, se proporcionó información relevante del ensayo para solo un tercio (6/18). Y solo cuatro de ellos habían comenzado a reclutar pacientes, mientras que dos compañías dijeron que todavía estaban en conversaciones con la FDA sobre el diseño final del estudio.
[…Cuando la eficacia no está clara, la FDA utiliza criterios de valoración sustitutos como sustituto de una medida directa de cómo se siente, funciona o sobrevive un paciente, y aunque es posible que no se mida el beneficio, se espera una predicción del beneficio clínico. En algunos casos, hay una fuerte indicación de que el criterio de valoración sustituto predice un beneficio significativo; sin embargo, donde la situación es menos sencilla, las inconsistencias y la falta de transparencia en torno a las decisiones han llevado a serias dudas sobre los estándares de evidencia aceptados…]
El artículo
Mahase E. FDA allows drugs without proven clinical benefit to languish for years on accelerated pathway BMJ 2021; 374 :n1898 doi:10.1136/bmj.n1898
ver también
- Artículos varios sobre aprobación acelerada
- Las decisiones de la EMA y la FDA para aprobar nuevos medicamentos contra el cáncer, basadas en evidencias débiles, afectan negativamente a los pacientes latinoamericanos
- Utilización de decisiones de autoridades regulatorias de otras jurisdicciones para aprobar nuevos productos medicinales en países de América Latina y el Caribe
- Posible impacto negativo de las decisiones de Agencias reguladoras reputadas sobre el estado de aprobación de nuevos medicamentos contra el cáncer en los países de América Latina