Farmacología

Fármacos biológicos y biosimilares: aclarando conceptos
30 mayo 2018
Aten Primaria, 29 de mayo de 2018 Se habla de medicamentos biológicos al referirse a principios activos que se obtienen a partir de material biológico, como fluidos, tejidos humanos o animales, o microorganismos. Cuando estos medicamentos se obtienen a partir de sistemas vivos en los que se ha implantado material genético con la tecnología del ADN recombinante, se les llama medicamentos biotecnológicos.
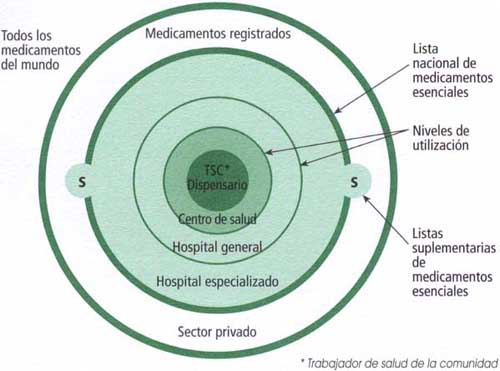
Costos estimados de producción y precios potenciales para la Lista de Medicamentos Esenciales de la OMS
19 abril 2018
BMJ Glob Health 2018 Una amplia gama de medicamentos en el LME se puede fabricar de forma rentable a muy bajo costo. La mayoría de los medicamentos LME se venden en el Reino Unido y Sudáfrica a precios significativamente más altos que los estimados a partir de los costos de producción. La estimación de precios genéricos y las comparaciones internacionales de precios podrían potenciar las negociaciones de precios gubernamentales y respaldar los cálculos de rentabilidad.
Fomentando nuevos usos para viejos fármacos
27 diciembre 2017
JAMA, 26 de diciembre de 2017 La aprobación de un nuevo medicamento por parte de la Administración de Drogas y Alimentos de los EE. UU. (FDA) generalmente coincide con un período de protección de patente, durante el cual el fabricante a menudo solicitará indicaciones adicionales para expandir el mercado del producto. El sistema de patentes de medicamentos existente está mal diseñado para motivar descubrimientos de nuevos usos para medicamentos no patentados.

La ausencia de competencia dispara el precio de medicamentos centenarios
13 diciembre 2017
Cuando el fabricante de un fármaco antiguo y no registrado previamente logra su aprobación por la FDA, obtiene una temporada de exclusividad en el mercado; como consecuencia, los precios se disparan hasta el 3.000% y el acceso al fármaco se compromete. JAMA, 12 de diciembre de 2017

Determinantes de la exclusividad del mercado de medicamentos de venta bajo receta en los Estados Unidos
14 septiembre 2017
