Farmacología

ANMAT. Guía de Comparabilidad para el desarrollo de productos Biosimilares
28 abril 2025
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (Anmat) a través de la Disposición 1741/25, estableció los "Requerimientos, Lineamientos y Criterios para el ejercicio de comparabilidad de especialidades medicinales biosimilares". ANMAT, marzo de 2025
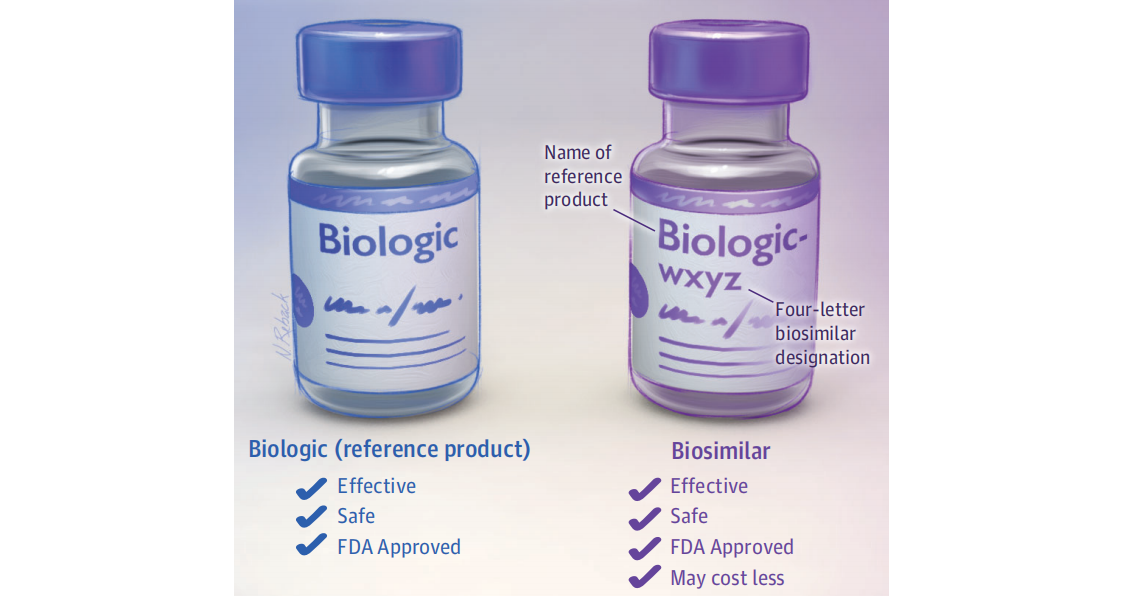
Impacto del uso de biosimilares en usuarios nuevos de etanercept para la artritis inflamatoria
16 abril 2025
No se observó un impacto significativo de la política de biosimilares ni del uso real de biosimilares en la utilización de la atención médica, lo que sugiere una efectividad y seguridad equivalentes en la práctica clínica a las de los biosimilares originales, sin consecuencias imprevistas del cambio de política. The Lancet Regional Health Americas, mayo de 2025.

Una comparación transnacional de precios de biosimilares en Argentina, Australia, Brasil e Italia
05 marzo 2024
El estudio reveló una marcada dispersión en las diferencias de precios entre biosimilares y el producto biológico de referencia entre los países estudiados. Los gobiernos deberían evaluar si sus políticas han tenido éxito en mejorar la asequibilidad de las terapias biológicas. Ther Innov Regul Sci, 4 de marzo de 2024.

Percepción de equivalencia farmacológica de genéricos o biosimilares en profesionales sanitarios de Viena
26 diciembre 2023
Los resultados de este estudio respaldan los resultados de encuestas anteriores que demuestran que una gran proporción de profesionales de la salud todavía se muestran escépticos acerca de los genéricos y biosimilares. Según los resultados de este estudio, una mejor educación del personal médico podría garantizar una mayor aceptación de este tipo de fármacos. Eur J Clin Pharmacol, 22 diciembre 2023

Aprobaciones de biosimilares por parte de trece autoridades reguladoras: una comparación transnacional
04 septiembre 2023
