Farmacología
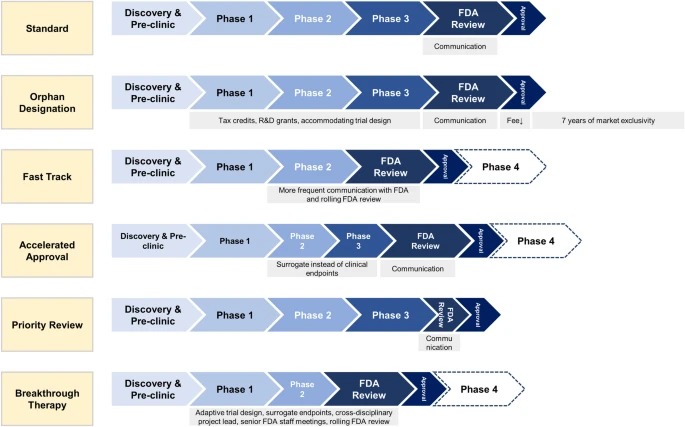
Designaciones especiales de la FDA para el desarrollo de medicamentos: huérfano, vía rápida, aprobación acelerada, revisión prioritaria y terapia innovadora
13 diciembre 2023
Las designaciones especiales de la FDA acortan los tiempos de desarrollo clínico y aprobación de la FDA para nuevos medicamentos que tratan enfermedades raras y graves con necesidades médicas no cubiertas. Los medicamentos especialmente designados ofrecen un mayor beneficio clínico a los pacientes. Sin embargo, los médicos, los pacientes y las aseguradoras deben ser conscientes de que los medicamentos designados especialmente a menudo se aprueban basándose en ensayos no sólidos, se asocian con más efectos secundarios no reconocidos y se venden a precios más altos. Eur J Health Econ, 14 noviembre 2023

FDA aprueba por "vía rápida" remdesivir para el COVID-19, más allá de la Autorización de Uso de Emergencia
23 octubre 2020
Es el primer tratamiento aprobado por la FDA para COVID-19. Fue sobre la base de tres ensayos clínicos controlados, pero sin mención de los resultados del Ensayo SOLIDARITY en el cual no demostró resultados beneficioso sobre la mortalidad. FDA , 22 de octubre de 2020

Desde Alemania piden frenar el plan europeo de aprobación de medicamentos por vía rápida
19 agosto 2016
