Farmacología
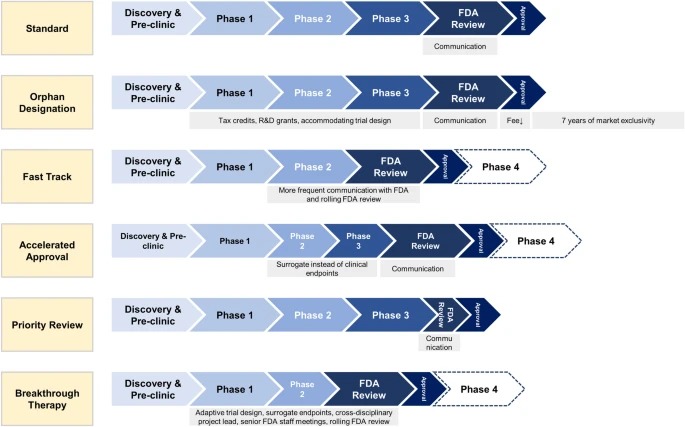
Designaciones especiales de la FDA para el desarrollo de medicamentos: huérfano, vía rápida, aprobación acelerada, revisión prioritaria y terapia innovadora
13 diciembre 2023
Las designaciones especiales de la FDA acortan los tiempos de desarrollo clínico y aprobación de la FDA para nuevos medicamentos que tratan enfermedades raras y graves con necesidades médicas no cubiertas. Los medicamentos especialmente designados ofrecen un mayor beneficio clínico a los pacientes. Sin embargo, los médicos, los pacientes y las aseguradoras deben ser conscientes de que los medicamentos designados especialmente a menudo se aprueban basándose en ensayos no sólidos, se asocian con más efectos secundarios no reconocidos y se venden a precios más altos. Eur J Health Econ, 14 noviembre 2023

Origen de los medicamentos “primeros en su clase”: innovación versus beneficio clínico
12 diciembre 2023
Los medicamentos designados como primero en su clase (PEC) son principalmente de origen industrial (> 70%) más que académico. Descubrimos que el 55% de los medicamentos PEC que ingresaron al mercado francés durante el período de 10 años no brindaron ningún beneficio clínico adicional. Si bien los medicamentos PEC pueden representar avances científicos importantes en el desarrollo de fármacos, en > 50% de los casos, el nuevo modo de acción no se traduce en beneficios clínicos adicionales para los pacientes. Clin Pharmacol Ther, 20 de noviembre de 2023

Códigos de ética y uso de medicamentos nuevos e innovadores.
10 enero 2019
