Farmacología

Características, calidad y volumen de los primeros 5 meses de la infodemia de síntesis de evidencia COVID-19
09 junio 2021
Al ser informados como "revisiones sistemáticas", muchos lectores pueden considerar las síntesis de evidencia como evidencia de alta calidad, independientemente de los métodos reales que se hayan adoptado. El desafío, especialmente en tiempos como el de esta pandemia, es proporcionar indicios de confiabilidad en las pruebas que están disponibles en "tiempo real". Los investigadores, los revisores y los editores de revistas deben asegurarse de que se hayan utilizado métodos sólidos para la investigación denominada revisiones sistemáticas. BMJ Evidence-Based Medicine, 3 de junio de 2021

La calidad de la evidencia de las intervenciones médicas no mejora ni empeora: un estudio metaepidemiológico de revisiones Cochrane
09 septiembre 2020
Las revisiones sistemáticas actualizadas continuaron sugiriendo que solo una minoría de los resultados de las intervenciones de atención médica están respaldados por evidencia de alta calidad. La calidad de la evidencia no mejoró o empeoró de manera consistente en las revisiones actualizadas. Journal of Clinical Epidemiology, 2 de septiembre de 2020
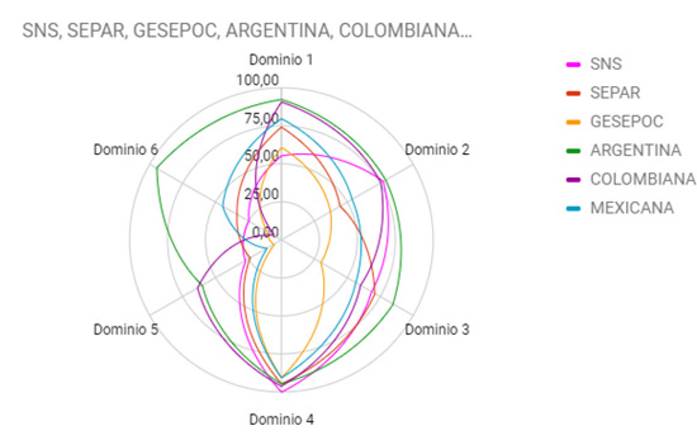
Calidad de las guías de práctica clínica para la EPOC
11 agosto 2020
Podemos decir que solo una de las guías obtuvo puntuación para clasificarla como Muy Buen Cumplimiento/Muy Alta puntuación; otras cuatro obtuvieron Buen Cumplimiento/Alta Puntuación; y, finalmente, la última Bajo Cumplimiento/Baja Puntuación. Rev. Esp. Salud Publica Septiembre 2020
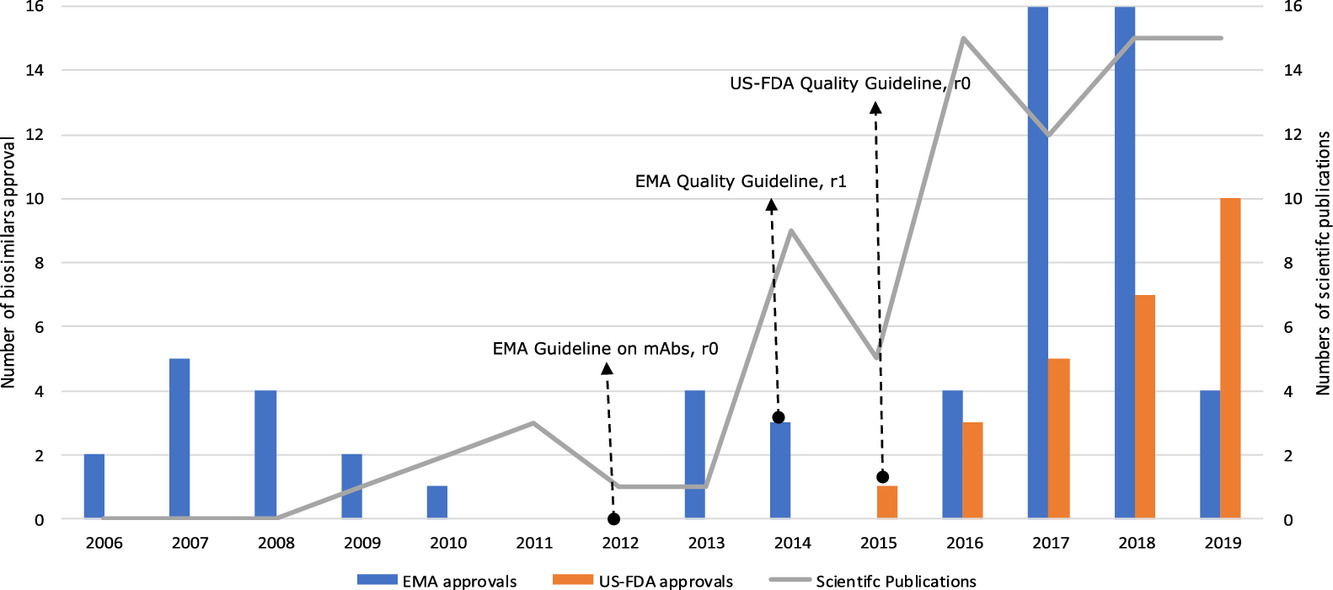
Informe de atributos de calidad en publicaciones científicas que presentan evaluaciones de biosimilaridad de biosimilares (previstos): una revisión sistemática de la literatura
31 julio 2020
Las evaluaciones de biosimilaridad de los atributos de calidad (QA) se han publicado en publicaciones científicas revisadas por pares para aproximadamente el 60% de los biosimilares aprobados. La dinámica de las publicaciones y los tipos de QA de informes aumentaron con el tiempo en paralelo con un mayor número de biosimilares con licencia y parece verse afectada por el desarrollo de pautas regulatorias en 2012-2015.La disponibilidad de una evaluación completa, públicamente accesible (acceso abierto) e imparcial de biosimilaridad de QA podría contribuir a una mayor confianza y aceptación de biosimilares en la práctica clínica. Eur J Pharm Sci, 30 de julio de 2020
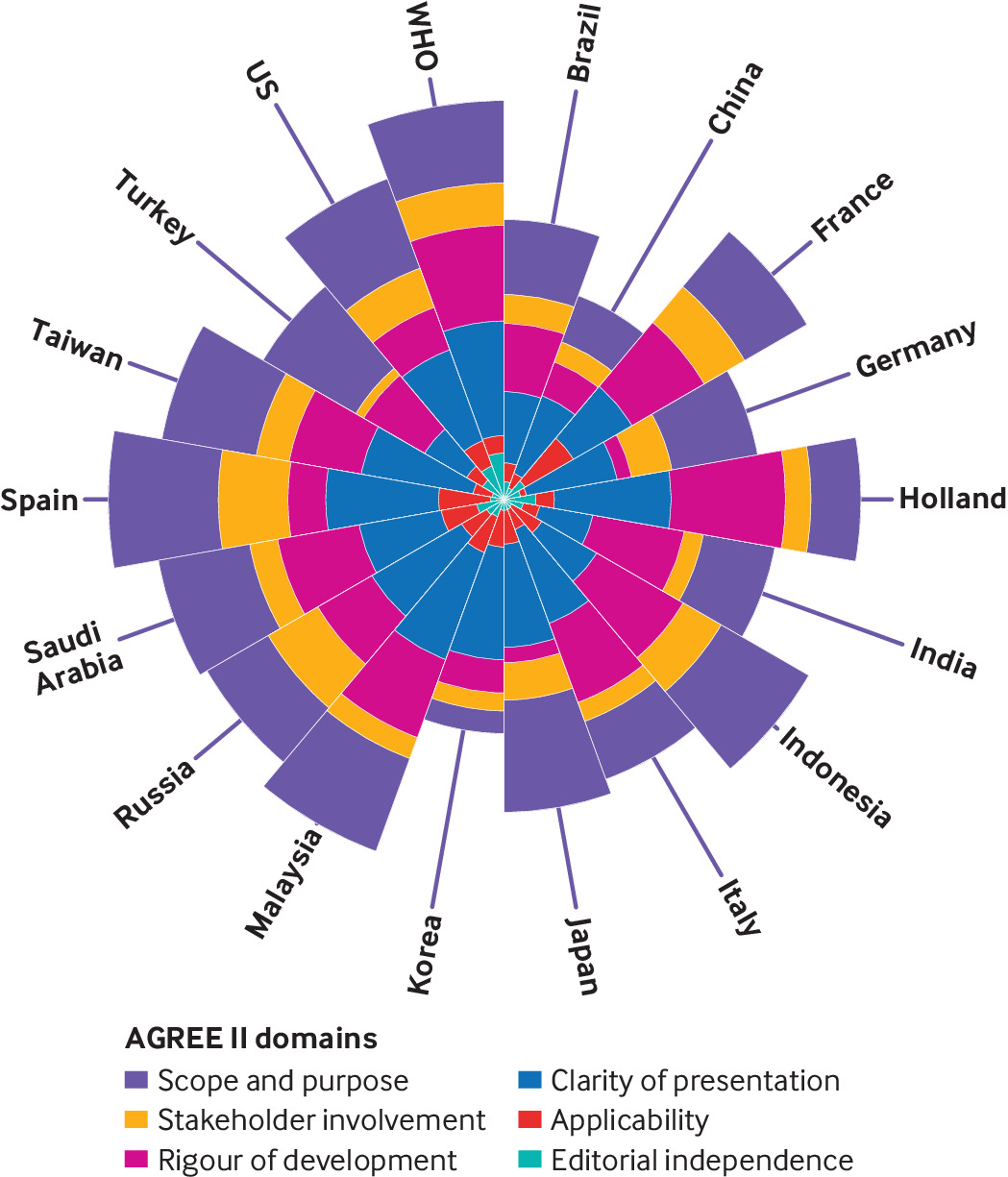
Extensión, calidad e inclusión de las guías clínicas producidas al comienzo de la pandemia de covid-19
27 mayo 2020
