Farmacología
Antibióticos para la infección respiratoria baja en Pediatría
23 septiembre 2021
En niños con infección respiratoria baja pero sin sospecha de neumonía, el agregado de amoxicilina no mostró eficacia en general ni para los subgrupos preestablecidos de pacientes con fiebre, signos torácicos, expectoración o disnea. The Lancet, 22 de septiembre de 2021.
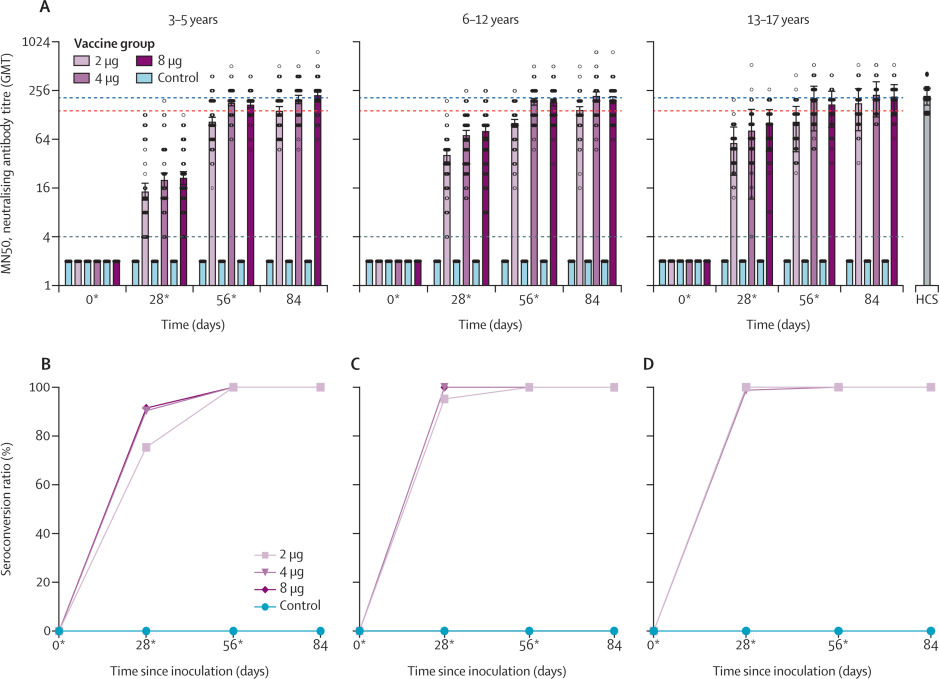
Seguridad e inmunogenicidad de una vacuna COVID-19 inactivada, BBIBP-CorV (Sinopharm), en personas menores de 18 años: un ensayo de fase 1/2 aleatorizado, doble ciego y controlado
20 septiembre 2021
La vacuna COVID-19 inactivada BBIBP-CorV es segura y bien tolerada en todos los niveles de dosis probados en participantes de 3 a 17 años. BBIBP-CorV también provocó fuertes respuestas humorales contra la infección por SARS-CoV-2 después de dos dosis. Nuestros hallazgos respaldan el uso de una dosis de 4 μg y un régimen de dos inyecciones de BBIBP-CorV en ensayos de fase 3 en la población menor de 18 años para determinar aún más su seguridad y eficacia de protección contra COVID-19. Lancet Infect Dis, 15 de septiembre de 2021
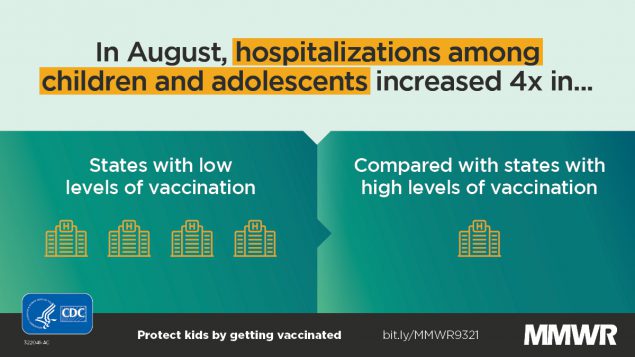
Tendencias en casos de COVID-19, visitas al departamento de emergencias e ingresos hospitalarios entre niños y adolescentes de 0 a 17 años - Estados Unidos, agosto de 2020 a agosto de 2021
07 septiembre 2021
Entre los niños y adolescentes de EE. UU. de 0 a 17 años, los casos de COVID-19 y las visitas al departamento de emergencias (DE) y los ingresos hospitalarios asociados aumentaron entre junio de 2021 y agosto de 2021. MMWR Morb Mortal Wkly Rep (CDC), 3 de septiembre de 2021
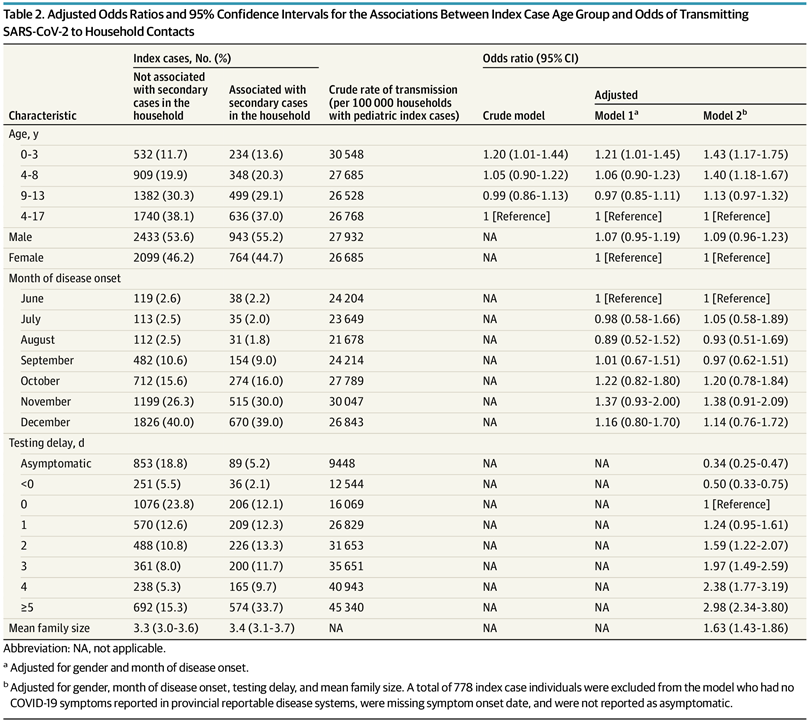
Asociación de la edad y la transmisión familiar pediátrica de la infección por SARS-CoV-2
19 agosto 2021
Este estudio sugiere que los niños más pequeños pueden ser más propensos a transmitir la infección por SARS-CoV-2 en comparación con los niños mayores, y las mayores probabilidades de transmisión se observaron en los niños de 0 a 3 años. La infectividad diferencial de los grupos de edad pediátrica tiene implicaciones para la prevención de infecciones en los hogares, así como en las escuelas y el cuidado de los niños, para minimizar el riesgo de transmisión secundaria en el hogar. Se requieren estudios poblacionales adicionales para establecer el riesgo de transmisión en los casos índice pediátricos más jóvenes. JAMA Pediatr. 16 de agosto de 2021

Vacuna COVID-19 Spikevax (Moderna) aprobada para niños de 12 a 17 años en la UE.
23 julio 2021
