Farmacología

¿Deberían las autoridades reguladoras aprobar medicamentos basados en desenlaces subrogados?
17 septiembre 2021
La controversia del aducanumab es el último ejemplo de criterios de valoración sustitutos que no predicen resultados clínicamente importantes. Sin embargo, como informan Jeanne Lenzer y Shannon Brownlee, se utilizan cada vez más como la base para las aprobaciones de medicamentos. BMJ 16 de septiembre de 2021
Los nuevos medicamentos y opciones pueden mejorar los resultados de los pacientes, pero ¿pueden también erosionarlos?
02 julio 2021
Discutimos 3 escenarios clínicos diferentes en los que tener más opciones puede conducir a peores resultados. Un fármaco nuevo puede desplazar a un fármaco antiguo que en realidad es superior.Se administran nuevos medicamentos para pacientes no aptos a pacientes aptos para una terapia agresiva.Las aprobaciones de terapia independiente del tejido de origen pueden desplazar mejores tratamientos específicos de tejidos.Eur J Cancer. 1 de julio de 2021

Evaluación de nuevos medicamentos: una colección online
08 octubre 2019
Un sitio del sistema nacional de salud británico recopila todas las evaluaciones de nuevos fármacos que realizan diez agencias nacionales o regionales, y permite su acceso desde Internet. Specialist Pharmacy Service, 7 de octubre de 2019

Evaluación de nuevos medicamentos en España y comparación con otros países europeos
16 agosto 2019
Gac Sanit. 2019 Basándose en estas evaluaciones, se propone una serie de recomendaciones para mejorar el proceso. España ha avanzado significativamente en ETS en los últimos años, pero aún falta garantizar la independencia de las agencias de ETS, eliminar la influencia de la política económica e industrial de los comités de decisiones sanitarias, fijar precios basados en el valor terapéutico, mejorar la transparencia del proceso y de los resultados de las evaluaciones, y por último, aumentar la participación de los grupos de interés.
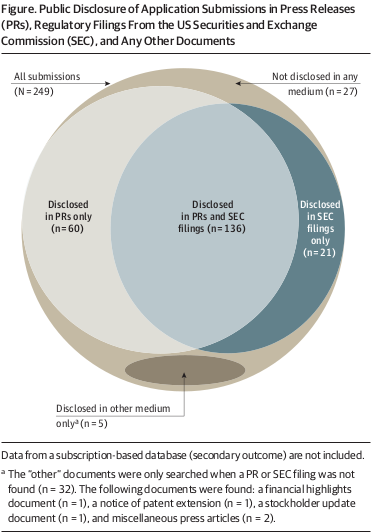
Divulgación pública de la presentación de solicitudes de nuevos medicamentos y productos biológicos terapéuticos ante la FDA
05 junio 2019
