Farmacología

Valor terapéutico de las primeras indicaciones de fármacos frente a las suplementarias en EE. UU. y Europa
06 julio 2023
La proporción de indicaciones complementarias calificadas como de alto valor terapéutico fue sustancialmente menor que para las primeras indicaciones. Cuando las indicaciones iniciales o complementarias no ofrezcan un valor terapéutico agregado sobre otros tratamientos disponibles, esa información debe comunicarse claramente a los pacientes y médicos y reflejarse en el precio de los medicamentos. British Medical Journal, 5 de julio de 2023.
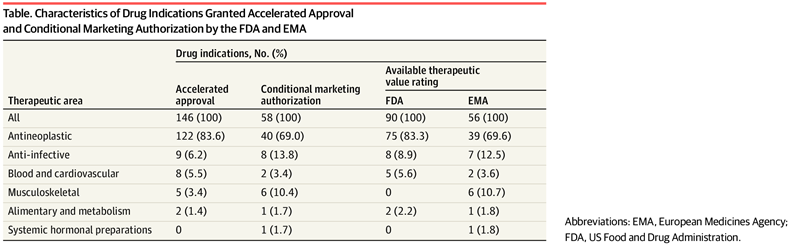
Valor terapéutico de los medicamentos con aprobación acelerada o autorización de comercialización condicional en los EE. UU. y Europa de 2007 a 2021
23 agosto 2022
En este estudio de cohortes, entre las nuevas indicaciones de medicamentos aprobadas a través de las vías de aprobación acelerada o autorización de comercialización condicional en los EE. UU. y Europa de 2007 a 2021, el 38,9 % y el 37,5 %, respectivamente, demostraron un alto valor terapéutico. Una proporción sustancialmente menor de indicaciones de cáncer que de indicaciones no oncológicas fueron calificadas como de alto valor terapéutico. Los encargados de formular políticas y los reguladores deben aumentar la aplicación de la finalización oportuna del estudio posterior a la aprobación para los medicamentos que califican para estas vías. JAMA Health Forum. 19 de agosto de 2022
El valor de los medicamentos contra el cáncer: una visión regulatoria
20 abril 2022
Aunque es poco probable que surja una definición única que capte completamente el concepto de valor, aquí discutimos la importancia de comprender las diferentes perspectivas y cómo los reguladores pueden ayudar a informar a los diferentes tomadores de decisiones. Nat Rev Clin Oncol, marzo 2022

Impacto de la Unión Europea en el acceso a medicamentos en países de ingresos bajos y medianos: revisión exploratoria
12 octubre 2021
Esta revisión revela que los tomadores de decisión de la UE adoptan medidas que, a pesar de la escasa evidencia que sustenta su impacto, positivo o negativo, tienen el potencial de influir en el acceso a los medicamentos de los países de bajo y mediano ingreso (PBMI). The Lancet Regional Health – Europe, 1 de octubre de 2021
FDA permite que los medicamentos sin un beneficio clínico comprobado permanezcan durante años en la vía acelerada
30 julio 2021
