Farmacología

Predictores de retirada de indicaciones de fármacos contra el cáncer con aprobación acelerada
02 junio 2025
Las aprobaciones aceleradas basadas en datos preliminares que sugieren un beneficio clínico limitado tienden a presentar tasas de abandono más altas, mientras que las terapias con la designación de Terapia Innovadora y mecanismos dirigidos al genoma tienen mayor probabilidad de validar los beneficios clínicos y obtener una aprobación regular. Los pacientes y los profesionales sanitarios deben considerar estos factores al evaluar las terapias con aprobación acelerada. eClinicalMedicine, 31 de mayo de 2025.

Tiempo hasta la aprobación total o el retiro de medicamentos contra el cáncer que recibieron aprobación acelerada por parte de la FDA
09 abril 2025
Este estudio de cohorte de 102 indicaciones de medicamentos oncológicos aprobados en forma acelerada entre 1992 y 2022 y que se convirtieron en aprobación regular para agosto de 2024, el bajo beneficio clínico o las preocupaciones de seguridad en la aprobación acelerada se asociaron con un retraso en la aprobación regular, lo que debería ser una señal de precaución para los pacientes y oncólogos que consideren su uso. JAMANetwork Open, 26 de marzo de 2025.
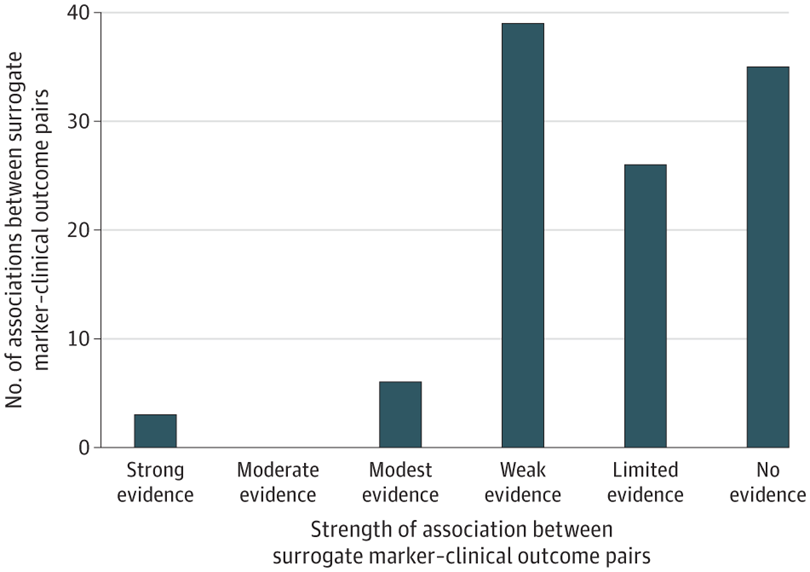
Asociaciones entre marcadores sustitutos y resultados clínicos para tratamientos de enfermedades crónicas no oncológicas
28 mayo 2024
La mayoría de las variables subrogadas utilizadas como puntos finales primarios en ensayos clínicos para respaldar la aprobación de la FDA de medicamentos para el tratamiento de enfermedades crónicas no oncológicas carecían de evidencia sólida de asociaciones con resultados clínicos de los metanálisis publicados. JAMA 22 de abril de 2024

Un análisis empírico de la supervivencia general en las aprobaciones de medicamentos por parte de la FDA de EE. UU. (2006-2023).
30 abril 2024
Alrededor del 32% de todas los medicamentos oncológicos aprobados por la FDA entre 2006 y 2023 tienen evidencia de una mejora en la sobrevida general. Se necesitan estándares más altos en la regulación de medicamentos para garantizar que los medicamentos aprobados brinden mejores resultados para los pacientes, específicamente en lo que respecta a la supervivencia. Cancer Medicine, 1º de abril de 2024.
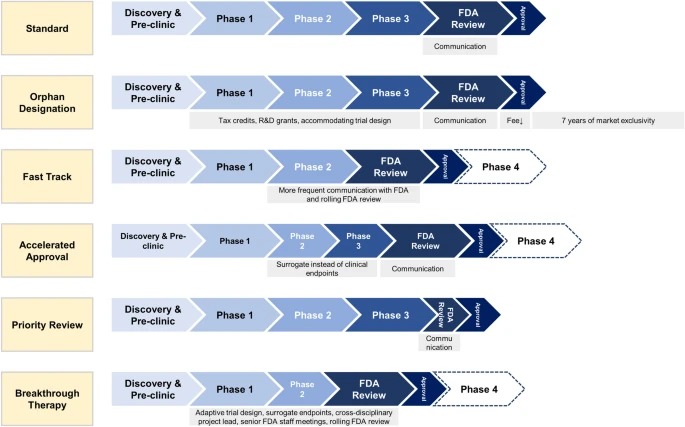
Designaciones especiales de la FDA para el desarrollo de medicamentos: huérfano, vía rápida, aprobación acelerada, revisión prioritaria y terapia innovadora
13 diciembre 2023
