Farmacología

Declaración sobre los fundamentos científicos que respaldan la intercambiabilidad de los medicamentos biosimilares en la Unión Europea (UE)
21 septiembre 2022
Los expertos de la UE en medicamentos biosimilares (Grupo de Trabajo de Medicamentos Biosimilares o BMWP) y el Grupo de Trabajo de Biosimilares de los Jefes de Agencias de Medicamentos (HMA) han redactado una declaración conjunta que explica los fundamentos para considerar biosimilares aprobados en la UE como intercambiables desde una perspectiva científica. EMA, 19 de septiembre de 2022

El impacto del cambio obligatorio no médico de la insulina original a la biosimilar de insulina glargina
06 julio 2022
Observamos cambios marginales en la utilización de los servicios de salud sin detectar señales de impactos negativos en la salud de los pacientes a los que se dirige la política de Columbia Británica de cambio obligatorio de insulina glargina original a biosimilar. Clin Ther. 12 de junio de 2022

Conceptos básicos de los Biosimilares para los pacientes
14 octubre 2020
Los biosimilares son medicamentos seguros y efectivos para el tratamiento de muchas enfermedades, tales como las enfermedades cutáneas e intestinales crónicas (como soriasis, síndrome de intestino irritable, enfermedad de Crohn y colitis), artritis, trastornos renales y cáncer. FDA, 8 de octubre de 2020

Aprobación de biosimilares por la FDA
06 octubre 2020
La mayoría de los ensayos de eficacia comparativa que respaldan la aprobación de biosimilares por la FDA parecen ser tan rigurosos y, a menudo, más grandes, más duraderos y más costosos que los ensayos que justificaron la aprobación de las nuevas entidades moleculares. JAMA Internal Medicine, 5 de octubre de 2020.
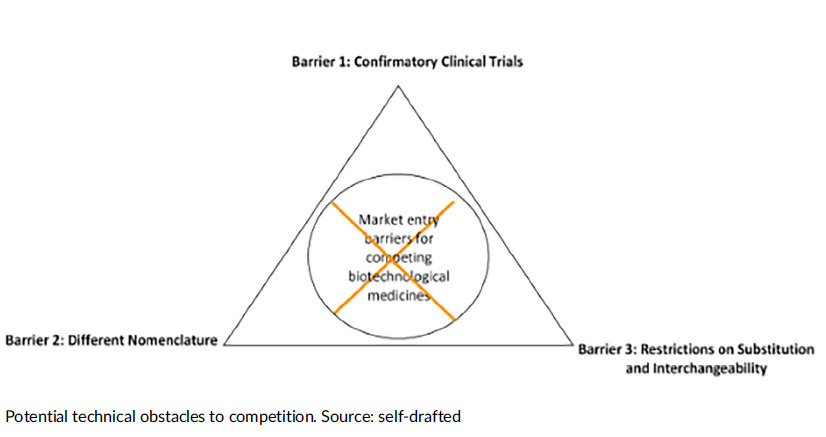
La controversia en torno a los estándares técnicos para productos bioterapéuticos similares: ¿barreras de acceso y competencia?
30 septiembre 2020
