Farmacología

ANMAT. Guía de Comparabilidad para el desarrollo de productos Biosimilares
28 abril 2025
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (Anmat) a través de la Disposición 1741/25, estableció los "Requerimientos, Lineamientos y Criterios para el ejercicio de comparabilidad de especialidades medicinales biosimilares". ANMAT, marzo de 2025
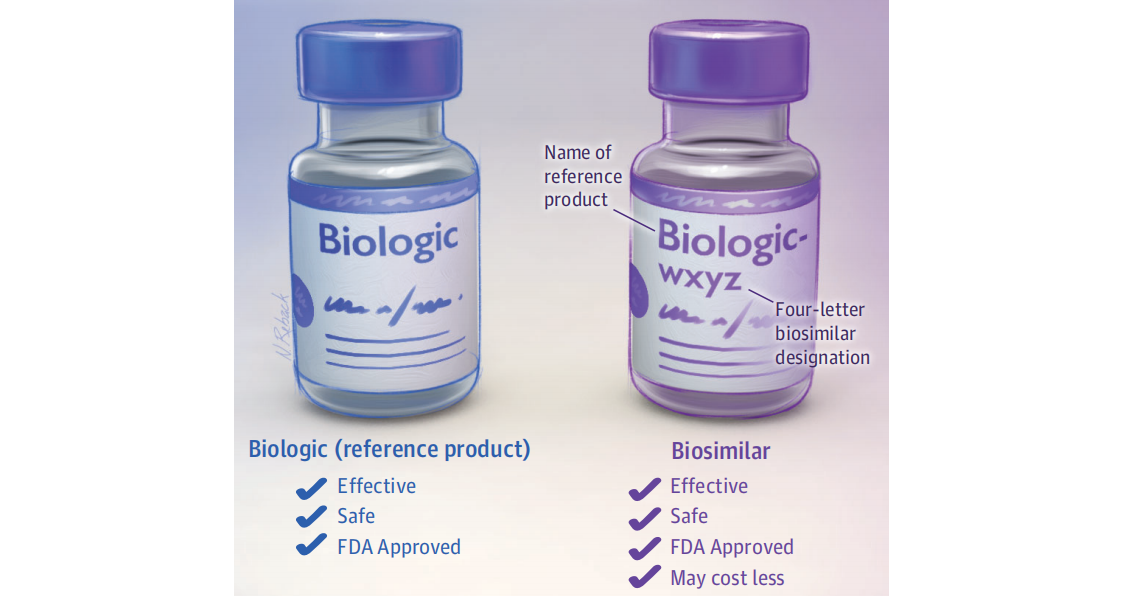
Impacto del uso de biosimilares en usuarios nuevos de etanercept para la artritis inflamatoria
16 abril 2025
No se observó un impacto significativo de la política de biosimilares ni del uso real de biosimilares en la utilización de la atención médica, lo que sugiere una efectividad y seguridad equivalentes en la práctica clínica a las de los biosimilares originales, sin consecuencias imprevistas del cambio de política. The Lancet Regional Health Americas, mayo de 2025.

Aprobaciones de biosimilares por parte de trece autoridades reguladoras: una comparación transnacional
04 septiembre 2023
En total, las jurisdicciones investigadas tuvieron de 19 a 78 biosimilares aprobados, la mayoría de ellos licenciados entre 2018 y 2020. A pesar del avance en el número de productos en los últimos años, aún persisten algunos desafíos. El acceso limitado a la información sobre la evaluación de biosimilares por parte de las Agencias Reguladoras puede afectar la confianza, lo que en última instancia puede afectar la adopción de estos productos en la práctica. Regul Toxicol Pharmacol. 31 de agosto de 2023

Comparación de consumo y precios de biosimilares en EE. UU., Alemania y Suiza
05 diciembre 2022
Los hallazgos de este estudio de cohorte sugieren que se han comercializado más biosimilares en Alemania y Suiza que en los EE. UU. Las políticas que contrarresten las prácticas anticompetitivas en los EE. UU. podrían permitir que los biosimilares ingresen al mercado antes y también podrían reducir los costos de atención médica con un mejor acceso. Se debe promover la concientización sobre los biosimilares para aumentar la aceptación de biosimilares a nivel mundial. JAMA Netw Open , 2 de diciembre de 2022

Seguridad y eficacia del cambio múltiple entre originales y biosimilares: revisión de la literatura e informe de estado sobre la intercambiabilidad
07 noviembre 2022
