Farmacología

Una comparación transnacional de precios de biosimilares en Argentina, Australia, Brasil e Italia
05 marzo 2024
El estudio reveló una marcada dispersión en las diferencias de precios entre biosimilares y el producto biológico de referencia entre los países estudiados. Los gobiernos deberían evaluar si sus políticas han tenido éxito en mejorar la asequibilidad de las terapias biológicas. Ther Innov Regul Sci, 4 de marzo de 2024.

Aprobaciones de biosimilares por parte de trece autoridades reguladoras: una comparación transnacional
04 septiembre 2023
En total, las jurisdicciones investigadas tuvieron de 19 a 78 biosimilares aprobados, la mayoría de ellos licenciados entre 2018 y 2020. A pesar del avance en el número de productos en los últimos años, aún persisten algunos desafíos. El acceso limitado a la información sobre la evaluación de biosimilares por parte de las Agencias Reguladoras puede afectar la confianza, lo que en última instancia puede afectar la adopción de estos productos en la práctica. Regul Toxicol Pharmacol. 31 de agosto de 2023

Antirreumáticos con diana: biológicos, biosimilares y dirigidos
20 noviembre 2019
Boletín terapéutico andaluz, BTA 34(3) 2019CADIME, 19 de noviembre de 2019Los FAME biológicos y los FAME dirigidos (que no son biológicos) se dirigen a dianas concretas para ejercer su efecto terapéutico. La inhibición de dianas específicas induce respuestas antiinflamatorias, pero también puede inducir respuestas inmunitarias indeseables, por lo que es importante la detección de infecciones, antes y durante el tratamiento con FAME biológicos y FAME dirigidos. También hay que vigilar: tumores malignos y linfoproliferativos, insuficiencia cardiaca, neumopatía y enfermedad desmielinizante.
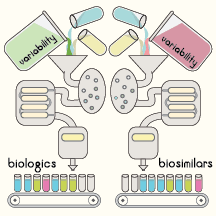
Biosimilares o productos biológicos: ¿Cuál es la diferencia?
13 noviembre 2019
Therapeutics letter [123], Therapeutics initiative, 11 de noviembre de 2019. un biosimilar es un "medicamento biológico que es muy similar a un medicamento biológico que ya estaba autorizado para la venta. No se esperan diferencias clínicamente significativas en la eficacia y la seguridad entre un biosimilar y el medicamento biológico que ya estaba autorizado para la venta ”. No hay dos lotes de producción de productos biológicos que sean idénticos. Los productos biológicos originales también tienen una variabilidad natural intrínseca porque los lotes pueden diferir y el proceso de fabricación puede cambiar por sí mismo.

Medicamentos Biosimilares: ¿a qué esperamos?
23 febrero 2018
