Farmacología
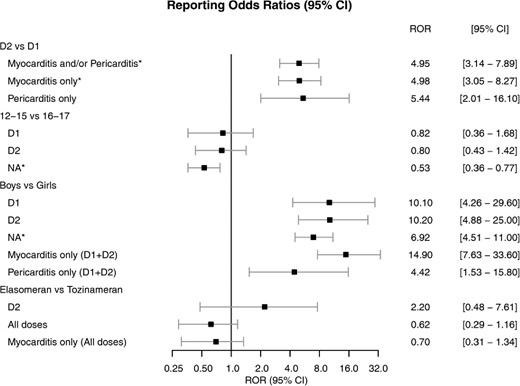
Miocarditis y pericarditis en adolescentes después de la primera y segunda dosis de vacunas mRNA COVID-19
04 marzo 2022
esta investigación, que incluye solo datos de adolescentes, sugiere por primera vez que la segunda dosis de las vacunas de ARNm contra la COVID-19 aumenta el riesgo de informar miocarditis/pericarditis en comparación con la primera dosis, particularmente en los niños, sin diferencias significativas entre tozinamerán y elasomeran. Eur Heart J Qual Care Clin Outcomes, 2 de marzo de 2022
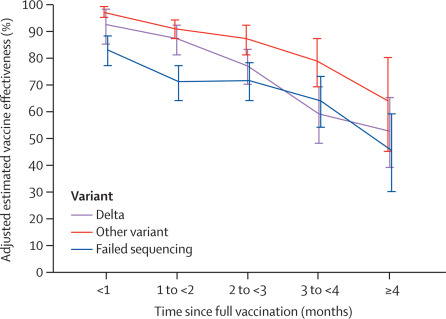
Efectividad de la vacuna ARNm BNT162b2 COVID-19 hasta 6 meses en un gran sistema de salud integrado en los EE. UU .: un estudio de cohorte retrospectivo
05 octubre 2021
Nuestros resultados apoyan la alta efectividad de BNT162b2 contra los ingresos hospitalarios hasta aproximadamente 6 meses después de haber sido completamente vacunado, incluso frente a la diseminación generalizada de la variante delta. La reducción de la eficacia de la vacuna contra las infecciones por SARS-CoV-2 a lo largo del tiempo probablemente se deba principalmente a la disminución de la inmunidad con el tiempo más que a la variante delta que escapa a la protección de la vacuna. Lancet, 4 de octubre de 2021

Recomendaciones de la EMA sobre terceras dosis y dosis de refuerzo de las vacunas frente a la COVID-19 Comirnaty (BioNTech/Pfizer) y Spikevax (Moderna)
05 octubre 2021
La agencia europea indica que podrían administrarse terceras dosis de las vacunas Comirnaty (BioNTech/Pfizer) y Spikevax (Moderna) a personas trasplantadas e inmunocomprometidas. También se podría considerar una dosis de refuerzo de Comirnaty a personas de más de 18 años que hayan recibido una segunda dosis hace, al menos, seis meses. Se consideran terceras dosis las que se administran a personas trasplantadas o inmunocomprometidas y dosis de refuerzo las que se administran a personas con un sistema inmune normal. AEMPS, 4 de octubre de 2021

La FDA autoriza una dosis de refuerzo de la vacuna contra el COVID-19 de Pfizer-BioNTech para determinadas poblaciones
24 septiembre 2021
La Administración de Alimentos y Medicamentos de los EE. UU. (FDA, por sus siglas en inglés) enmendó la autorización de uso de emergencia (EUA, por sus siglas en inglés) de la vacuna contra el COVID-19 de Pfizer-BioNTech para permitir el uso de una dosis única de refuerzo, que se administrará al menos seis meses después de completar la serie primaria con la vacuna contra el COVID-19 de Pfizer-BioNTech en: personas de 65 años o mayores, personas de 18 a 64 años de edad con alto riesgo de contraer COVID-19 grave; y personas de 18 a 64 años de edad cuya exposición institucional u ocupacional frecuente al SARS-CoV-2 los pone en alto riesgo de complicaciones graves por COVID-19, incluyendo COVID-19 de gravedad. FDA, 22 de septiembre de 2021
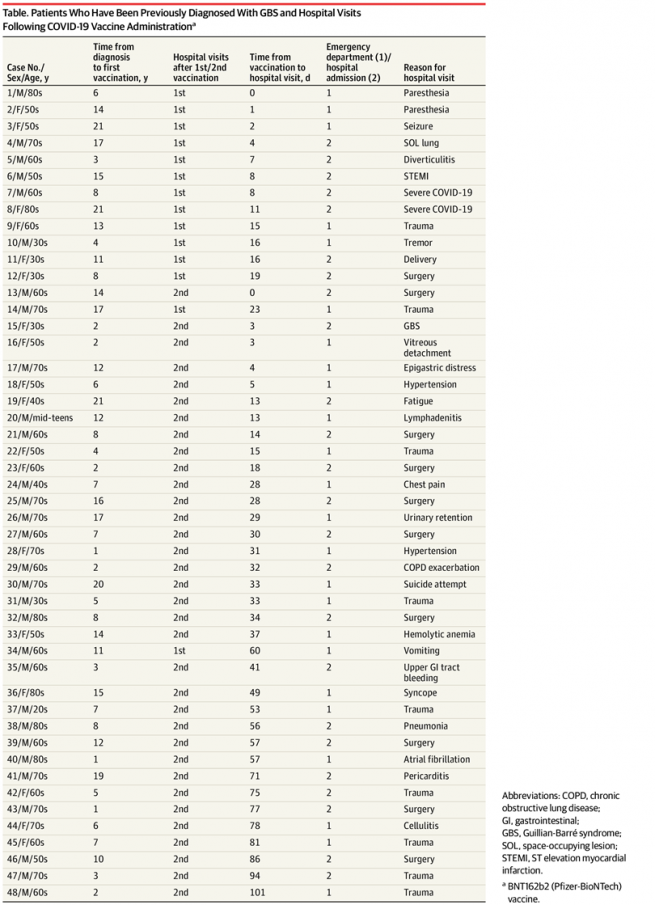
Recurrencia del Síndrome de Guillain-Barré después de la vacuna de ARNm Pfizer-BioNTech
10 septiembre 2021
