Farmacología

Seguridad de los medicamentos para enfermedades cardiovasculares aprobados entre 2014 y 2021 en EE. UU.: un análisis de farmacovigilancia
22 mayo 2024
Este estudio identificó preocupaciones de seguridad específicas relacionadas con los medicamentos para enfermedades cardiovasculares aprobados recientemente. Se requiere más investigación para comprender los mecanismos subyacentes y las implicaciones clínicas de estos hallazgos. Expert Rev Cardiovasc Ther. 12 de mayo de 2024
Veinte años de medicamentos inmunomoduladores biológicos y dirigidos: Modificaciones posteriores a la comercialización del etiquetado de los medicamentos aprobados por la FDA
08 agosto 2022
Los problemas de seguridad asociados con los fármacos inmunomoduladores biológicos y dirigidos a menudo se identifican después de la comercialización, con intervalos de tiempo considerables después de la aprobación inicial. Los médicos deben seguir de cerca las actualizaciones de los perfiles de seguridad de los medicamentos inmunomoduladores y estar atentos a los eventos adversos no identificados previamente. Mayo Clin Proc, agosto de 2022
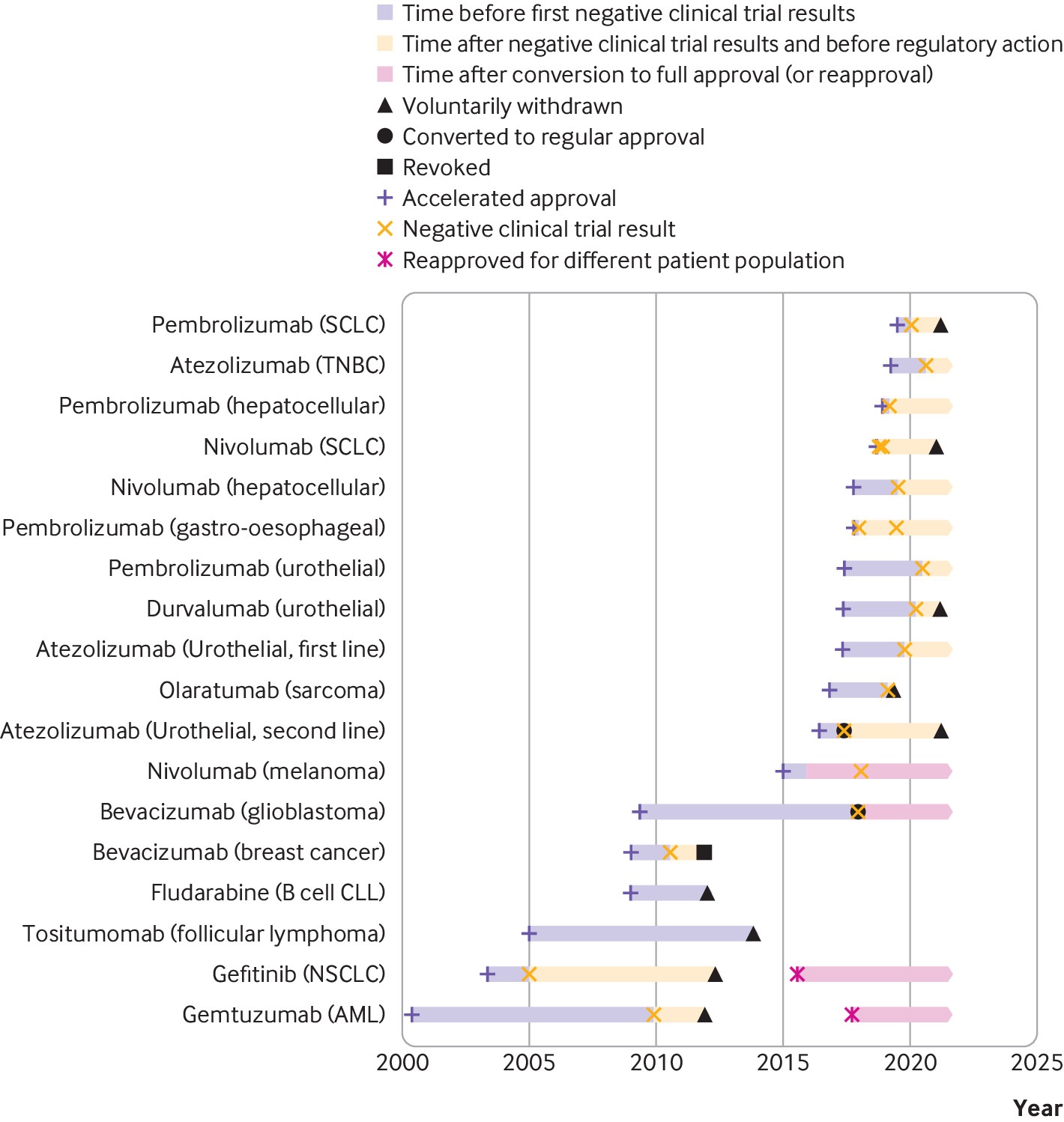
Consecuencias regulatorias y clínicas de los ensayos confirmatorios negativos de medicamentos contra el cáncer de aprobación acelerada
13 septiembre 2021
Las indicaciones de medicamentos contra el cáncer que recibieron una aprobación acelerada a menudo permanecieron en el etiquetado formal de medicamentos aprobados por la FDA y continuaron recomendándose en las guías clínicas varios años después de que los ensayos posteriores a la aprobación requeridos por ley no mostraran una mejoría en el criterio de valoración de eficacia primario. Las guías clínicas deben alinearse mejor con los resultados de los ensayos posteriores a la aprobación de medicamentos contra el cáncer que recibieron una aprobación acelerada. BMJ, 9 de septiembre de 2021

Evaluación de los informes post comercialización con resultado de muerte, en el sistema de notificación de eventos adversos de la FDA de EE. UU.
30 enero 2020
