Farmacología

La FDA aprueba la ranitidina reformulada tras una revisión exhaustiva de seguridad
25 noviembre 2025
La nueva formulación aborda los problemas previos de formación de impurezas de N-nitrosodimetilamina (NDMA) . FDA 24 de noviembre de 2025
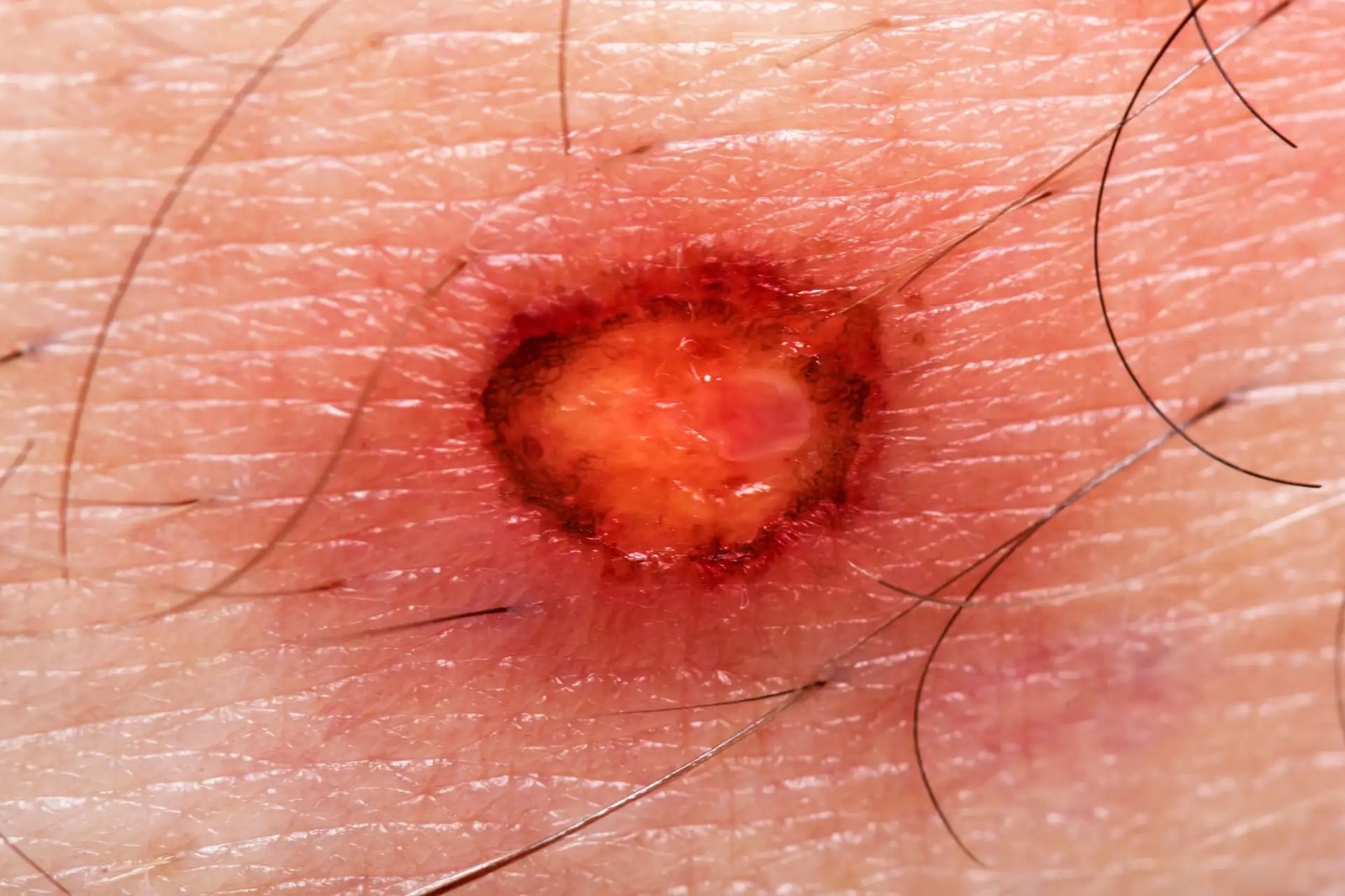
Úlcera cutánea inducida por fármacos: análisis de farmacovigilancia en el mundo real basado en el sistema de notificación de eventos adversos de la FDA
19 febrero 2025
Nuestro estudio identificó 32 fármacos potencialmente inductores de úlceras cutáneas (UC), lo que proporciona información valiosa para las estrategias de prevención y tratamiento dirigidas a mitigar el riesgo de UC inducida por fármacos. Expert Opin Drug Saf, 18 de febrero de 2025.

Inhibidores del cotransportador de sodio-glucosa tipo 2 y cáncer renal en el sistema de notificación de eventos adversos de la FDA
25 septiembre 2024
Se observó una asociación desproporcionada entre los inhibidores del cotransportador de sodio-glucosa 2 (SGLT2) y el cáncer renal, lo que respalda los resultados del metanálisis actual que indican un mayor riesgo de cáncer renal asociado con los inhibidores de SGLT2. Eur J Clin Pharmacol, 17 de septiembre de 2024

Eventos adversos de alto riesgo asociados con cetirizina y loratadina para el tratamiento de enfermedades alérgicas: estudio retrospectivo de farmacovigilancia
12 septiembre 2024
En comparación con la loratadina, la cetirizina plantea un mayor riesgo potencial en los sistemas nervioso y psiquiátrico. Además, este estudio revela una posible toxicidad cardíaca de la cetirizina que se había subestimado anteriormente; aunque con una tasa de incidencia relativamente baja, la alta intensidad de la señal justifica una mayor atención y exploración. Estos hallazgos resaltan la necesidad de mejorar la monitorización del paciente y optimizar la terapia al prescribir estos medicamentos, asegurando un mejor manejo de las enfermedades alérgicas y minimizando los riesgos. Clin Transl Allergy, septiembre de 2024
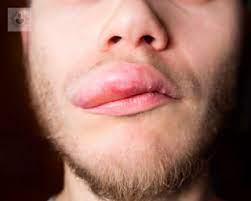
Riesgo de angioedema inducido por medicamentos: un estudio de farmacovigilancia de la base de datos del sistema de notificación de eventos adversos de la FDA
08 agosto 2024
