Farmacología

Recopilación de datos sobre eventos adversos relacionados con medicamentos: una encuesta entre registros en la base de datos de recursos de ENCePP
27 junio 2022
La baja tasa de respuesta puede indicar poco interés en este tema o que los registros no se desarrollaron originalmente para la recopilación de datos de rutina sobre eventos adversos / reacciones adversas a medicamentos y, en última instancia, para monitorear la seguridad de los medicamentos. Los resultados indican que se necesita una guía clara sobre la recopilación y el uso de datos del mundo real en los marcos regulatorios y una colaboración fortalecida entre los titulares de registros, la academia, los reguladores y los desarrolladores de medicamentos para lograr niveles completos y de alta calidad de datos de seguridad capturados por los registros para apoyar la toma de decisiones regulatorias. Se espera que estos sean habilitados por la estrategia de la Red Europea de Regulación de Medicamentos para 2025. Drug Saf, 21 de junio de 2022

Evaluación de la similitud y la coherencia de los tres principales recursos en línea sobre interacción entre fármacos
22 abril 2022
Existe una variación considerable en la información de interacción fármaco-fármaco (IFF) incluidos en los recursos de información sobre fármacos (RIF) examinados, junto con la variabilidad en la categorización de la gravedad y el asesoramiento clínico proporcionado. Los IFF etiquetados como críticos tenían más probabilidades de aparecer en varios RIF. Tal variabilidad en la información podría tener consecuencias perjudiciales para la seguridad del paciente, y existe la necesidad de armonización y estandarización. Br J Clin Pharmacol, 31 de marzo de 2022
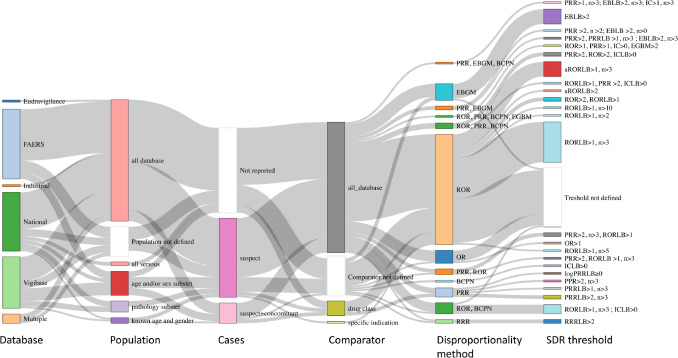
Un estudio metaepidemiológico encontró falta de transparencia e informes deficientes de los análisis de desproporcionalidad para la detección de señales en las bases de datos de farmacovigilancia.
04 enero 2022
Nuestra encuesta plantea importantes preocupaciones con respecto a todos los aspectos de los análisis de desproporcionalidad que podrían conducir a resultados engañosos y generar alarmas injustificadas. Abogamos por un fundamento sólido y transparente para la selección de variables, la elección de la población y los comparadores preespecificados en un protocolo y evaluados mediante análisis de sensibilidad. J Clin Epidemiol, noviembre de 2021

Fuentes de datos para la investigación sobre la utilización de medicamentos en países de América Latina: un estudio transnacional: estudio DASDUR-LATAM.
29 diciembre 2021
Aunque hay varias fuentes de EUM disponibles en los países de América Latina, la accesibilidad es un gran desafío. Los procedimientos para acceder a los datos para EUM deben ser transparentes, factibles, asequibles y basados en protocolos. Este inventario podría permitir una comparación de la utilización de medicamentos entre países que identifiquen posibles problemas relacionados con los medicamentos que necesitan una mayor exploración. Pharmacoepidemiol Drug Saf, 26 de diciembre de 2021

Transparencia de datos para construir un sistema de salud más sólido: estudio de caso de bases de datos administrativas argentinas sobre utilización de medicamentos
28 mayo 2021
