Farmacología

Mirtazapina actualización sobre eficacia, seguridad, dosis-respuesta
10 mayo 2021
Therapeutics Letter [129] Therapeutics Intiative, 6 demayo de 2021

Advertencias de seguridad de los medicamentos: La necesidad de una coordinación internacional
14 abril 2021
las advertencias de 5 agencias reguladoras difieren significativamente en frecuencia, enfoque y contenido, reflejando diferencias en la autoridad legislada, las capacidades de la agencia y la transparencia. La redacción de las alertas de seguridad también refleja el nivel de participación de la industria farmacéutica. Es posible que los prescriptores y los pacientes de un país sean alertados antes que sus homólogos de otros lugares. versión en español oficial del Therapeutics Letter [128] , abril de 2021

Advertencias sobre seguridad de los medicamentos necesidad de coordinación internacional
09 diciembre 2020
las advertencias de 5 agencias reguladoras difieren significativamente en frecuencia, enfoque y contenido, reflejando diferencias en la autoridad legislada, las capacidades de la agencia y la transparencia. La redacción de las alertas de seguridad también refleja el nivel de participación de la industria farmacéutica5. Es posible que los prescriptores y los pacientes de un país sean alertados antes que sus homólogos de otros lugares. Therapeutics Letter 3 de diciembre de 2020
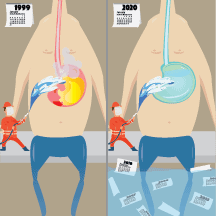
Daños graves por el uso largo plazo de inhibidores de la bomba de protones (IBPs) en adultos mayores
29 junio 2020
Los estudios observacionales han identificado señales de efectos adversos graves asociados a la exposición a IBPs a largo plazo, incluido un aumento del riesgo de muerte.Incluso los ECAs de gran tamaño pueden no detectarlos si la exposición o el seguimiento no son suficientemente largos. Los resultados del ensayo COMPASS no son coherentes con los hallazgos de los estudios observacionales actuales.Los clínicos y pacientes pueden revertir el incesante aumento de la exposición a IBPs a largo plazo mediante la revisión de las indicaciones y la reconsideración de los daños y beneficios potenciales. Therapeutics Letter junio 26, 2020

¿Pueden los prescriptores evitar contribuir al trastorno por consumo de opioides?
05 junio 2020
