Farmacología

Mitos y verdades sobre la vacunas contra el coronavirus
30 noviembre 2020
El documento elaborado por el Ministerio de Salud de la Nación sobre mitos y verdades sobre la vacunación Covid-19 en Argentina. Responde a las preguntas ¿Por qué si el desarrollo de vacunas demanda años, esta vez el proceso se hace en tiempo récord? ¿Se están salteando pasos? ¿Será obligatorio vacunarse contra el coronavirus? ¿La vacunación terminará automáticamente con la pandemia? Ministerio de Salud de la Nación noviembre de 2020

Sobre las vacunas en fase III para COVID-19
24 noviembre 2020
Consideraciones sobre los anuncios de Pfizer-BioNTech, Sputnik V, Moderna y Oxford-Astra Zeneca, Boletín DIME, nº 26, 18 noviembre de 2020.
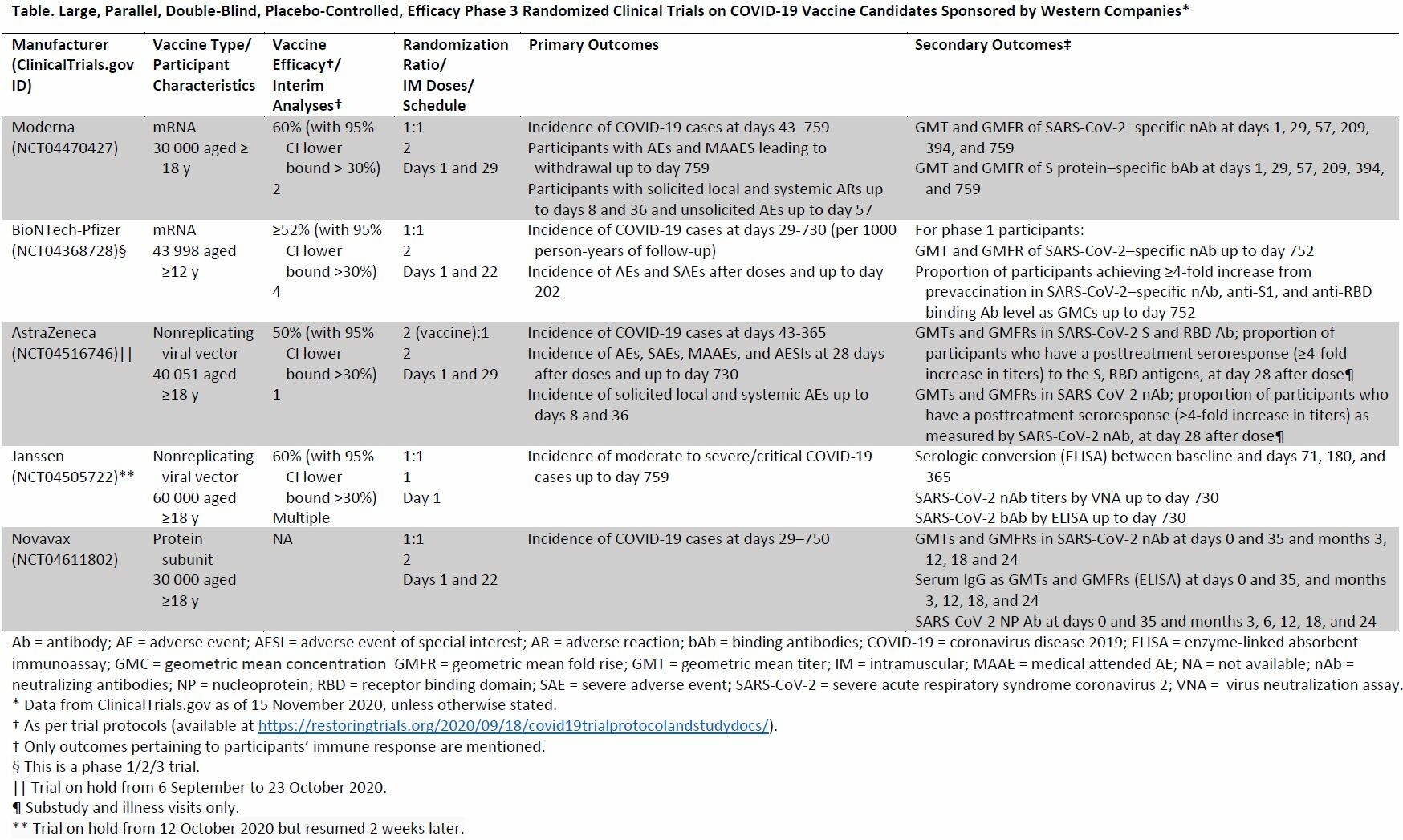
Consideraciones éticas y científicas respecto a la aprobación temprana y de implementación de una vacuna COVID-19
24 noviembre 2020
Este escenario no responderá preguntas sobre la eficacia y seguridad a largo plazo, que requieren datos de un mayor número de meses. Además, la implementación temprana podría interferir con la obtención de datos a largo plazo. En los países donde se implementa la vacuna aprobada y el ensayo original continúa, los investigadores deben informar a los participantes del estudio sobre el estado de la vacuna aprobada porque esta información podría afectar su voluntad de continuar participando en el ensayo Ann Intern Med, 20 de noviembre de 2020

Seguridad e inmunogenicidad de la vacuna ChAdOx1 nCoV-19 administrada en un régimen de refuerzo primario en adultos jóvenes y ancianos (COV002): un ensayo simple ciego, aleatorizado, controlado, de fase 2/3
19 noviembre 2020
ChAdOx1 nCoV-19 parece ser mejor tolerado en adultos mayores que en adultos jóvenes y tiene una inmunogenicidad similar en todos los grupos de edad después de una dosis de refuerzo. Se justifica una evaluación adicional de la eficacia de esta vacuna en todos los grupos de edad e individuos con comorbilidades. Lancet ,18 de noviembre de 2020
Seguridad, tolerabilidad e inmunogenicidad de una vacuna inactivada (CoronaVac ) contra el SARS-CoV-2 en adultos sanos de 18 a 59 años: ensayo clínico de fase 1/2 aleatorizado, doble ciego, controlado con placebo
18 noviembre 2020
