Farmacología
La necesidad de distinguir las vacunas COVID-19, y los nombres genéricos
24 febrero 2021
La asignación de una Denominación común internacional (DCI) única y distinta a las sustancias activas de cada vacuna contribuiría a una prescripción segura, una distribución transnacional, una farmacovigilancia mejorada y, en última instancia, la seguridad de los receptores de la vacuna, como ocurre con las sustancias medicinales terapéuticas. Lancet 4 de febrero de 2021

FDA autoriza anticuerpos monoclonales (bamlanivimab y etesevimab ) juntos para el tratamiento del COVID-19
10 febrero 2021
La Administración de Medicamentos y Alimentos de EE. UU. emitió una autorización de uso de emergencia (EUA) para bamlanivimab y etesevimab administrados juntos para el tratamiento de COVID-19 leve a moderado en pacientes adultos y pediátricos (12 años de edad o más que pesen al menos 40 kilogramos ) que dan positivo al SARS-CoV-2 y que tienen un alto riesgo de progresar a COVID-19 grave. FDA , 9 de febrero de 2021

El Ministerio de Salud de la Nación autorizó la vacuna Gam-COVID-Vac (SPUTNIK V)
24 diciembre 2020
Se aprobó mediante la Resolución 2784/2020 del Ministerio de Salud (ver al final), que se basa en la información que recibió la ANMAT sobre la seguridad y eficacia de la vacuna Instituto Gamaleya y a las tareas desarrolladas por la Comisión Nacional de Inmunizaciones que ha prestado su aval correspondiente. Ministerio de Salud de la Nación.23 de diciembre de 2020.

ANMAT: Registro de emergencia de la vacuna de la firma Pfizer S.R.L. "COMIRNATY"
23 diciembre 2020
La autorizó bajo la modalidad de registro de emergencia la vacuna contra el virus SARS-CoV-2 de la firma Pfizer S.R.L.ANMAT, 22 de diciembre de 2020
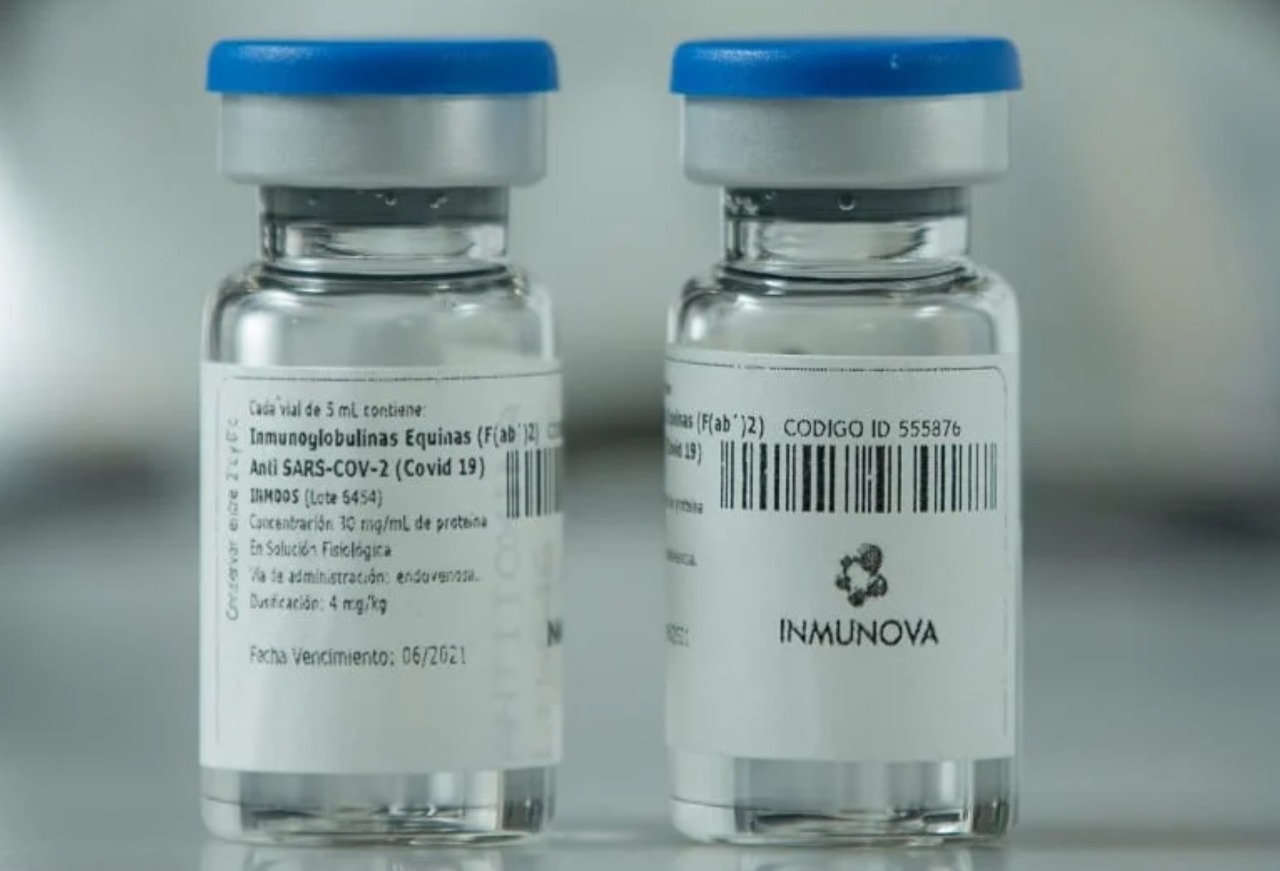
La ANMAT aprobó el suero equino hiperinmune
23 diciembre 2020
