Farmacología
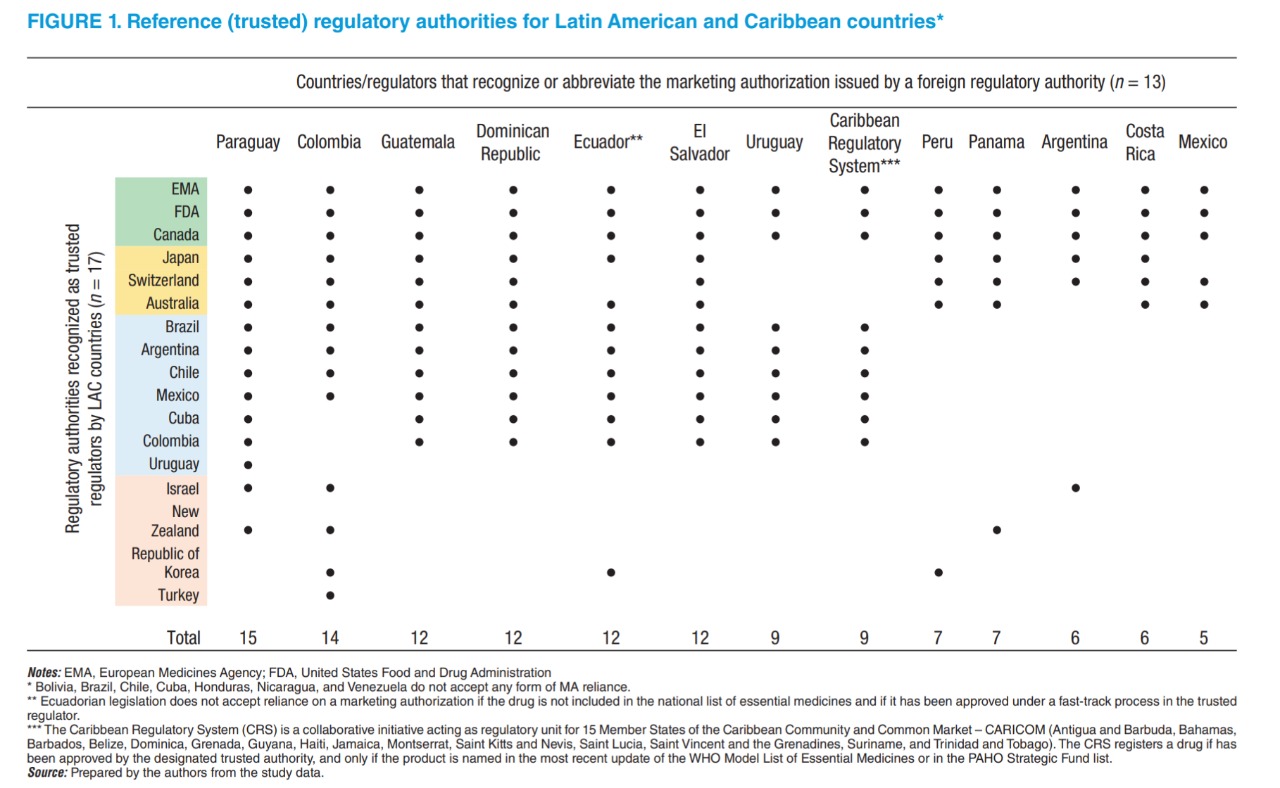
Utilización de decisiones de autoridades regulatorias de otras jurisdicciones para aprobar nuevos productos medicinales en países de América Latina y el Caribe
09 abril 2021
La utilización de las decisiones de autoridades regulatorias de otras jurisdicciones se han convertido en una práctica común en América Latina y el Caribe. Trece de veinte autoridades regulatorias reconocen directamente o abrevian el proceso de aprobación de nuevos medicamentos en caso de que hayan recibido previamente la aprobación por parte de un organismo regulatorio de otra jurisdicción. La Agencia Europea de Medicamentos, la Administración de Alimentos y Medicamentos de Estados Unidos y Salud Canadá son las autoridades regulatorias de otras jurisdicciones en las cuales los reguladores de América Latina y el Caribe confían más. Rev Panam Salud Publica, 9 de abril de 2021

La revisión integrada: la FDA moderniza la revisión de nuevas aplicaciones de comercialización de medicamentos
03 diciembre 2020
Este artículo describe los orígenes y la justificación del nuevo proceso de Evaluación Integrada y el documento de Revisión Integrada, resume en qué se diferencian de la revisión tradicional de las aplicaciones de marketing de la FDA y analiza lo que la industria puede esperar de una revisión de medicamentos modernizada. Ther Innov Regul Sci 24 de noviembre de 2020

Evaluación adecuada, por el bien de los pacientes.
15 julio 2020
La evaluación adecuada de los medicamentos, basada en ensayos diseñados para proporcionar evidencia de nivel suficientemente alto y resultados concluyentes, utilizando resultados clínicos relevantes para el paciente, es la mejor manera de garantizar que los medicamentos se usen con prudencia, sin causar daños innecesarios. Prescrire 1 de julio de 2020

¿Son aptos los nuevos métodos analíticos no aleatorizados para la toma de decisiones regulatorias?
03 octubre 2019
El análisis de grandes bases de datos genera una oleada de estudios con diseños no aleatorizados, cuya utilidad y aplicación requiere una previa validación prospectiva, controlada y transparente de sus posibilidades. Clinical Pharmacology & Therapeutics, 1° de octubre de 2019

Concordancia entre EMA y FDA en las autorizaciones de nuevos medicamentos
21 agosto 2019
