Farmacología
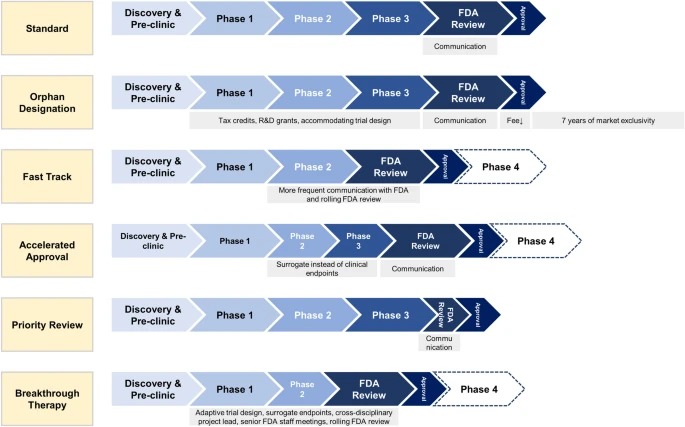
Designaciones especiales de la FDA para el desarrollo de medicamentos: huérfano, vía rápida, aprobación acelerada, revisión prioritaria y terapia innovadora
13 diciembre 2023
Las designaciones especiales de la FDA acortan los tiempos de desarrollo clínico y aprobación de la FDA para nuevos medicamentos que tratan enfermedades raras y graves con necesidades médicas no cubiertas. Los medicamentos especialmente designados ofrecen un mayor beneficio clínico a los pacientes. Sin embargo, los médicos, los pacientes y las aseguradoras deben ser conscientes de que los medicamentos designados especialmente a menudo se aprueban basándose en ensayos no sólidos, se asocian con más efectos secundarios no reconocidos y se venden a precios más altos. Eur J Health Econ, 14 noviembre 2023

Tiempo de revisión de los medicamentos oncológicos y sus factores subyacentes: una exploración en China
06 noviembre 2023
El breve retraso en el lanzamiento en relación con los EE. UU. fue un factor importante para la velocidad de revisión de la Administración Nacional de Productos Médicos de China, lo que podría sugerir su dependencia regulatoria latente del otro regulador global durante el período posterior a la comercialización, cuando aún faltaba nueva información sobre el beneficio clínico del medicamento. Front. Pharmacol., 1 de noviembre de 2023

Duración de la revisión regulatoria y diferencias en los tiempos de presentación de medicamentos en Estados Unidos y Europa, 2011 a 2020
17 octubre 2023
Sería beneficioso para los pacientes si se siguieran minimizando las diferencias en los tiempos de presentación entre Estados Unidos y Europa. Ann Intern Med. 17 de octubre de 2023

Evaluación de los comparadores empleados en los estudios pivotales de nuevos medicamentos e indicaciones
21 marzo 2023
Aproximadamente uno de cada cuatro nuevos medicamentos o indicaciones carece de una comparación suficiente en el momento de empezar a ser utilizado en la práctica clínica. La proporción no mejora a lo largo de los últimos 10 años. Las agencias reguladoras deben ser más exigentes en la selección del comparador para los ensayos clínicos pivotales, por cuestiones éticas y sanitarias. Rev. OFIL·ILAPHAR, marzo de 2023
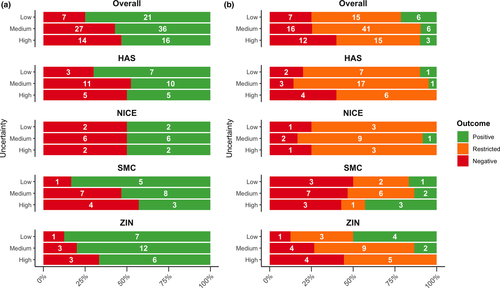
Asociación entre las incertidumbres identificadas por la Agencia Europea de Medicamentos y la toma de decisiones nacional sobre el reembolso por parte de las agencias de ETS
18 mayo 2021
