Farmacología

Aprobaciones de biosimilares por parte de trece autoridades reguladoras: una comparación transnacional
04 septiembre 2023
En total, las jurisdicciones investigadas tuvieron de 19 a 78 biosimilares aprobados, la mayoría de ellos licenciados entre 2018 y 2020. A pesar del avance en el número de productos en los últimos años, aún persisten algunos desafíos. El acceso limitado a la información sobre la evaluación de biosimilares por parte de las Agencias Reguladoras puede afectar la confianza, lo que en última instancia puede afectar la adopción de estos productos en la práctica. Regul Toxicol Pharmacol. 31 de agosto de 2023
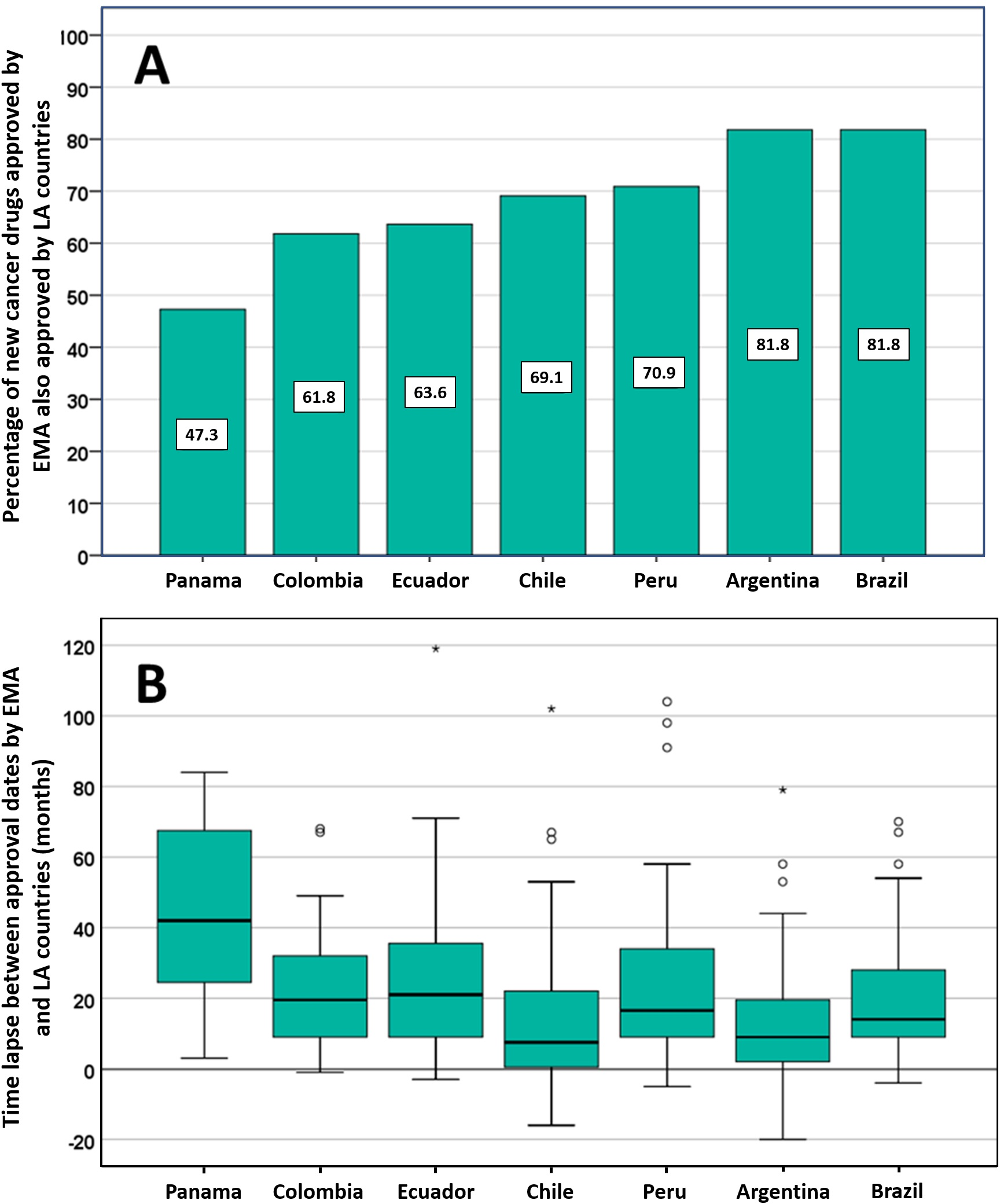
Posible impacto negativo de las decisiones de Agencias reguladoras reputadas sobre el estado de aprobación de nuevos medicamentos contra el cáncer en los países de América Latina
14 julio 2021
Los países de América Latina siguen aprobando nuevos medicamentos contra el cáncer, a menudo basándose en ensayos clínicos mal realizados que miden criterios de valoración sustitutos. La EMA y otros reguladores de renombre deben ser conscientes de que sus decisiones regulatorias pueden influir directamente en las decisiones relativas a la autorización de comercialización, los presupuestos de salud y la atención del paciente en otros lugares. PLoS ONE 13 de julio de 2021
Drug Safety Update - junio de 2021
22 junio 2021
La Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA) ha publicado la Actualización de seguridad de los medicamentos para junio de 2021.18 de junio de 2021

Fingolimod (▼Gilenya): nuevas recomendaciones para prevenir el riesgo de daño hepático
06 noviembre 2020
Se han identificado casos de daño hepático, incluidos cuadros graves que requirieron trasplante, en pacientes tratados con fingolimod (Gilenya).Es necesario por tanto realizar pruebas de función hepática, antes, durante y después del tratamiento.Ante la aparición de síntomas de lesión hepática se debe realizar determinación de enzimas hepáticas y bilirrubina. Si se confirma daño hepático significativo se interrumpirá el tratamiento.En ausencia de síntomas de lesión hepática, ante aumentos de transaminasas de al menos 5 veces el LSN, o de al menos 3 veces el LSN asociado con un aumento de la bilirrubina sérica, se deberá interrumpir el tratamiento.Es importante indicar a los pacientes que consulten con su médico en caso de que aparezcan síntomas sugestivos de lesión hepática durante el tratamiento. AEMPS 6 de noviembre de 2020

FDA, Benzodiazepinas Actualización de la advertencia de recuadro para mejorar el uso seguro
25 septiembre 2020
