Farmacología

Aprobaciones de biosimilares por parte de trece autoridades reguladoras: una comparación transnacional
04 septiembre 2023
En total, las jurisdicciones investigadas tuvieron de 19 a 78 biosimilares aprobados, la mayoría de ellos licenciados entre 2018 y 2020. A pesar del avance en el número de productos en los últimos años, aún persisten algunos desafíos. El acceso limitado a la información sobre la evaluación de biosimilares por parte de las Agencias Reguladoras puede afectar la confianza, lo que en última instancia puede afectar la adopción de estos productos en la práctica. Regul Toxicol Pharmacol. 31 de agosto de 2023
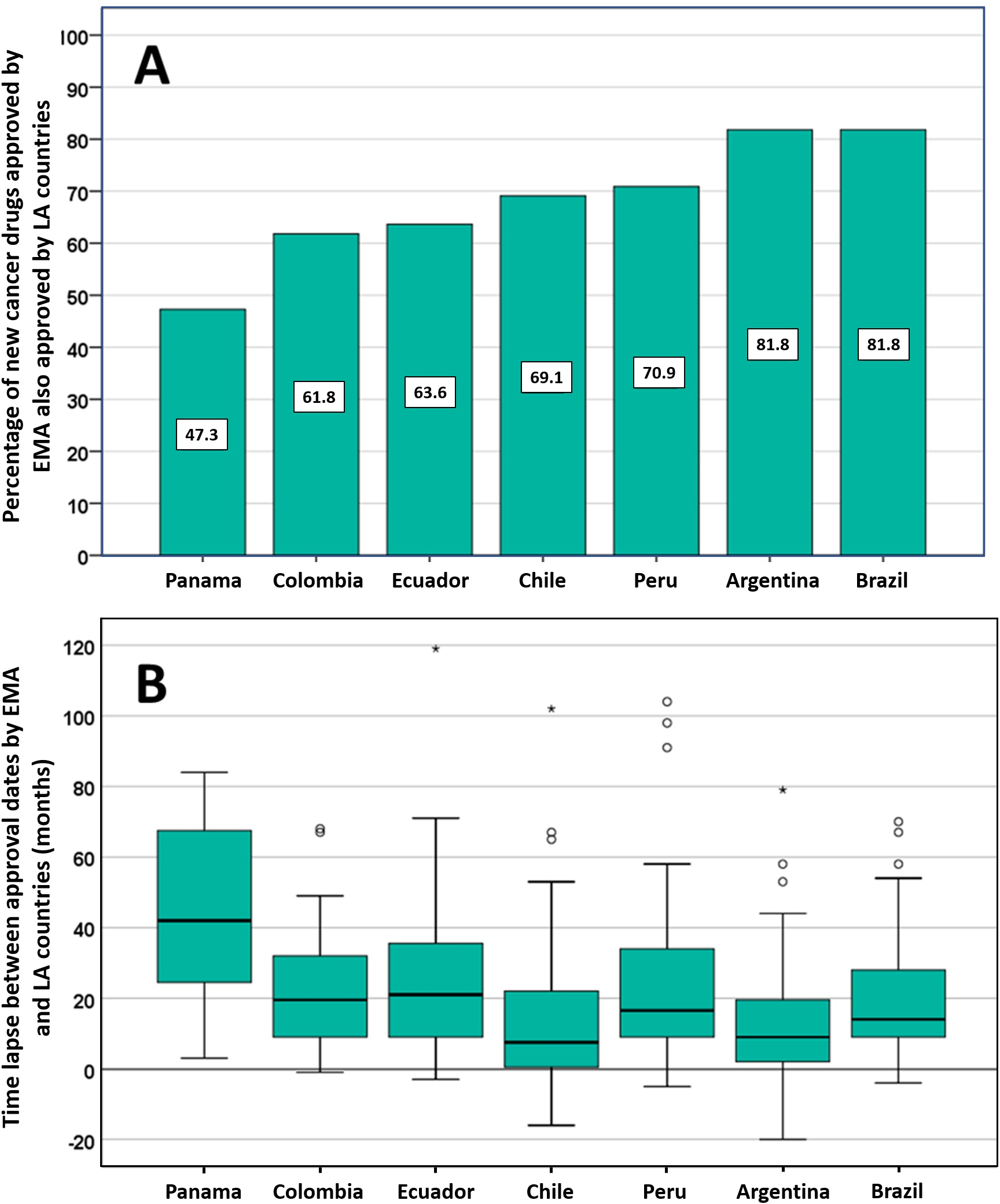
Posible impacto negativo de las decisiones de Agencias reguladoras reputadas sobre el estado de aprobación de nuevos medicamentos contra el cáncer en los países de América Latina
14 julio 2021
Los países de América Latina siguen aprobando nuevos medicamentos contra el cáncer, a menudo basándose en ensayos clínicos mal realizados que miden criterios de valoración sustitutos. La EMA y otros reguladores de renombre deben ser conscientes de que sus decisiones regulatorias pueden influir directamente en las decisiones relativas a la autorización de comercialización, los presupuestos de salud y la atención del paciente en otros lugares. PLoS ONE 13 de julio de 2021
Diclofenac: Impacto de los cambios en el etiquetado de EMA en el inicio, la interrupción y el cambio a otros medicamentos para el dolor en Escocia, Inglaterra, Dinamarca y los Países Bajos
20 febrero 2020
La acción reguladora se asoció con reducciones significativas en el inicio general de diclofenac que variaron según el país y el tipo de exposición. No hubo impacto en la interrupción e impacto variable en el cambio. Pharmacoepidemiol Drug Saf. 3 de enero de 2020
Las decisiones de la EMA y la FDA para aprobar nuevos medicamentos contra el cáncer, basadas en evidencias débiles, afectan negativamente a los pacientes latinoamericanos
23 octubre 2019
BMJ, 15 de octubre de 2019

Rivaroxaban (Xarelto): interrupción prematura de un estudio en curso tras detectarse un aumento de la mortalidad por todas las causas y de los acontecimientos tromboembólicos y hemorrágicos en pacientes sometidos a reemplazo valvular aórtico transcatéter
03 octubre 2018
