Farmacología

Aprobaciones de biosimilares por parte de trece autoridades reguladoras: una comparación transnacional
04 septiembre 2023
En total, las jurisdicciones investigadas tuvieron de 19 a 78 biosimilares aprobados, la mayoría de ellos licenciados entre 2018 y 2020. A pesar del avance en el número de productos en los últimos años, aún persisten algunos desafíos. El acceso limitado a la información sobre la evaluación de biosimilares por parte de las Agencias Reguladoras puede afectar la confianza, lo que en última instancia puede afectar la adopción de estos productos en la práctica. Regul Toxicol Pharmacol. 31 de agosto de 2023
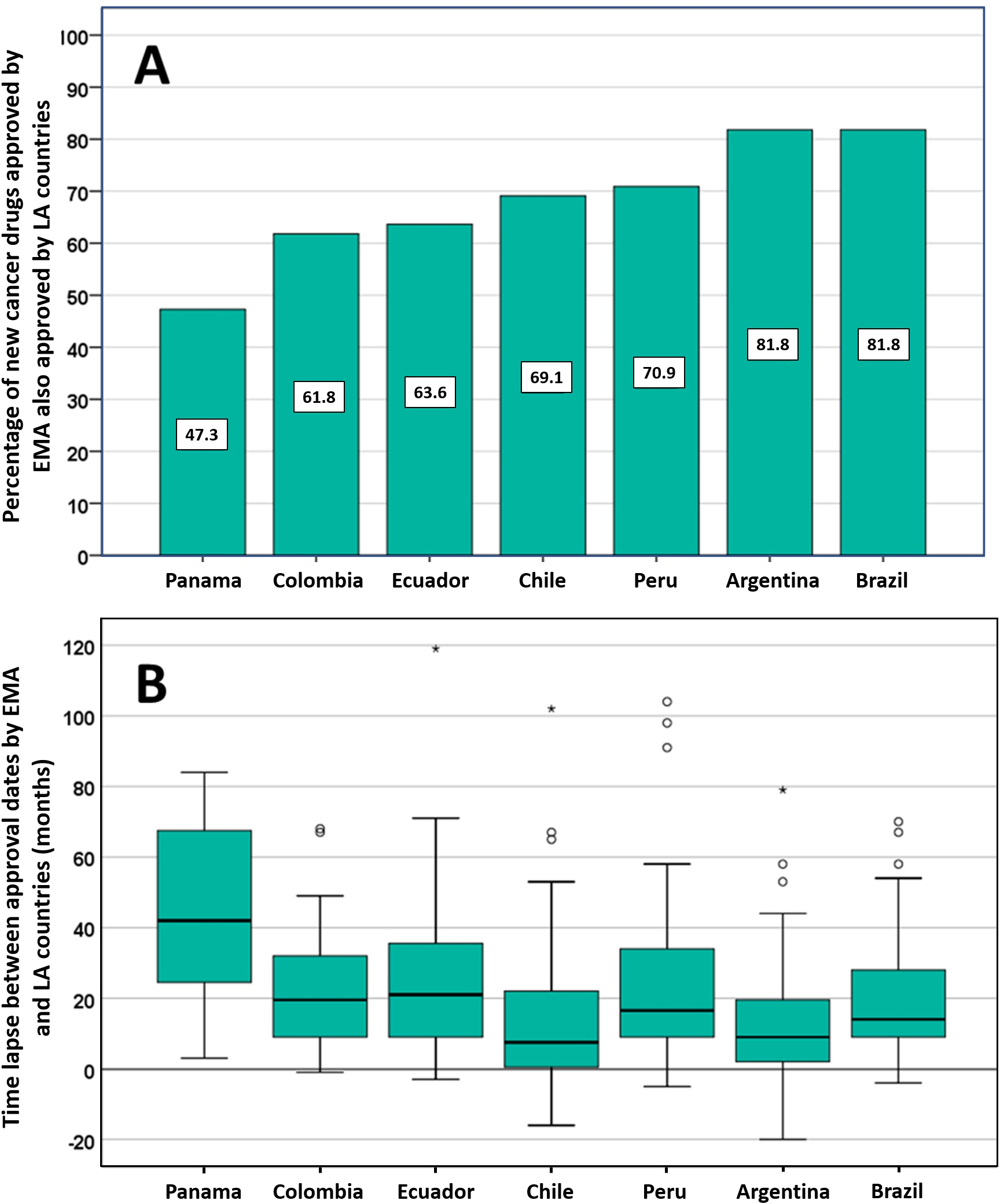
Posible impacto negativo de las decisiones de Agencias reguladoras reputadas sobre el estado de aprobación de nuevos medicamentos contra el cáncer en los países de América Latina
14 julio 2021
Los países de América Latina siguen aprobando nuevos medicamentos contra el cáncer, a menudo basándose en ensayos clínicos mal realizados que miden criterios de valoración sustitutos. La EMA y otros reguladores de renombre deben ser conscientes de que sus decisiones regulatorias pueden influir directamente en las decisiones relativas a la autorización de comercialización, los presupuestos de salud y la atención del paciente en otros lugares. PLoS ONE 13 de julio de 2021

Evaluación de ensayos clínicos que respaldan la aprobación de la Administración de Alimentos y Medicamentos de los EE. UU. de nuevos agentes terapéuticos, 1995-2017
22 abril 2020
Este estudio encontró cambios en la evidencia que respalda la aprobación de la Administración de Alimentos y Medicamentos de nuevos medicamentos y productos biológicos. Estos cambios sugieren que es necesario evaluar, de manera continua, la seguridad y la eficacia terapéutica después de la aprobación. JAMA Netw Open 21 de abril de 2020;

Evaluar la seguridad de los medicamentos en niños: el papel de los datos del mundo real
12 junio 2018
N Engl J Med , 7 de junio de 2018 Existen importantes lagunas en la evidencia con respecto a la seguridad de muchas drogas en niños. Cada vez más, los estudios que evalúan la seguridad de los medicamentos pueden incorporar datos obtenidos en el curso de la atención clínica para generar evidencia en el mundo real y ayudar a llenar estos vacíos.

Ensayos exploratorios, criterios de valoración indirectos: una base no sólida para la autorización de comercialización
15 mayo 2018
