Farmacología

Ataluren para Duchenne: cómo la política y la presión social minaron las decisiones basadas en la evidencia
17 diciembre 2025
Los autores concluyen que el caso de ataluren constituye un ejemplo paradigmático de los riesgos asociados a aprobar y mantener en el mercado medicamentos huérfanos sin evidencia sólida de beneficio clínico. Subrayan la necesidad de reforzar la independencia regulatoria, exigir ensayos confirmatorios rigurosos y oportunos, promover estudios independientes y registros de pacientes, y proteger los sistemas de salud de decisiones influenciadas por expectativas infundadas, presión social o intereses políticos, en detrimento de la equidad, la sostenibilidad y la medicina basada en la evidencia. BMJ Evidence-Based Medicine, 13 de diciembre de 2025
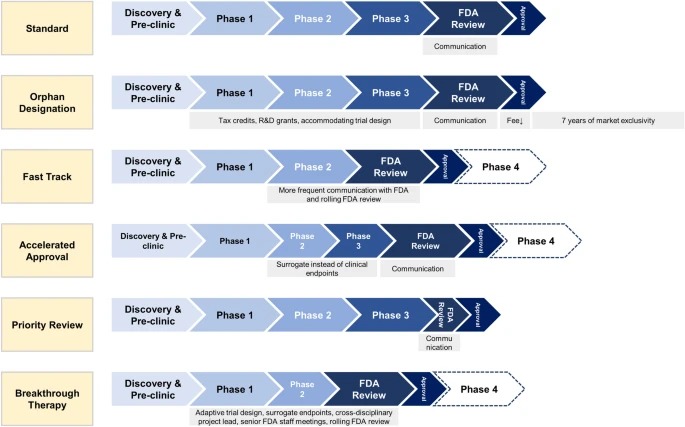
Designaciones especiales de la FDA para el desarrollo de medicamentos: huérfano, vía rápida, aprobación acelerada, revisión prioritaria y terapia innovadora
13 diciembre 2023
Las designaciones especiales de la FDA acortan los tiempos de desarrollo clínico y aprobación de la FDA para nuevos medicamentos que tratan enfermedades raras y graves con necesidades médicas no cubiertas. Los medicamentos especialmente designados ofrecen un mayor beneficio clínico a los pacientes. Sin embargo, los médicos, los pacientes y las aseguradoras deben ser conscientes de que los medicamentos designados especialmente a menudo se aprueban basándose en ensayos no sólidos, se asocian con más efectos secundarios no reconocidos y se venden a precios más altos. Eur J Health Econ, 14 noviembre 2023

Fármacos oncológicos aprobados por FDA según categoría asignada de medicamento huérfano
11 mayo 2023
La Ley de Medicamentos Huérfanos de 1983 incentiva el desarrollo de medicamentos no solo para enfermedades raras sino también para enfermedades ultra raras y subconjuntos de enfermedades comunes. Estas indicaciones huérfanas cubren importantes necesidades insatisfechas, pero su aprobación se basa en ensayos pequeños y poco sólidos que podrían sobrestimar los resultados de eficacia. Una designación distinta de ultrahuérfano con mayores incentivos financieros podría fomentar y acelerar el desarrollo de fármacos para enfermedades ultrararas. British Medical Journal, 9 de mayo de 2023.
Gasto público en medicamentos huérfanos: revisión de la literatura
13 octubre 2020
Se publicó un número reducido de estudios que informaron sobre el gasto farmacéutico en medicamentos huérfanos, de los cuales solo unos pocos analizaron explícitamente los datos de gasto de los pagadores públicos. Una síntesis concluyente del gasto público en medicamentos huérfanos es un desafío dado a la diversidad de metodologías para medir el gasto. Es necesario realizar más investigaciones para estudiar los datos primarios del gasto público en medicamentos huérfanos, sobre la base de una metodología sólida para medir estos datos y compararlos internacionalmente. J of Pharm Policy and Pract 13 de octubre de 2020

Implementación de los principios de evaluación de tecnologías sanitarias en las decisiones públicas sobre medicamentos huérfanos
01 abril 2020
